Indice del volumen
Volume index
Comité Editorial
Editorial Board
Comité Científico
Scientific Committee
INFLUENCIA DEL TRATAMIENTO CON AMINAS
EN LOS PARAMETROS HEMODINAMICOS y METABOLICOS
EN EL SHOCK SEPTICO EXPERIMENTAL
Arturo Zabalegui Perez, Martin de Frutos Herranz, Maria Jesus Lopez Pueyo,
Alberto Indarte Boyero, Teresa Saldaña Fernandez, Felisa Alonso Garcia, Jose Cordero Guevara
Servicio de Medicina Intensiva. Hospital General Yagüe. Burgos. España
zabalegui @ hgy.esRev Electron Biomed / Electron J Biomed 2003;1(2):64-78
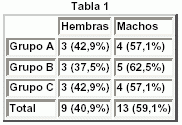
- Grupo A (Control) (n = 7): Grupo que no recibió tratamiento con aminas y sirvió de control.
- Grupo B (DPDB) (n = 8): Tras la inducción del shock séptico ("t = 30"), fue tratado con las mismas medidas de soporte que el grupo A y una asociación de aminas:
- En primer lugar con dopamina a 10 mcg/kg/min más dobutamina a 5 mcg/kg/min durante 30 minutos. Al final de este periodo se le denominó "t = 60" por haber transcurrido 60 minutos desde el inicio de la experimentación.
- Treinta minutos después del inicio de la infusión con estas dos aminas, se asoció a las mismas tratamiento con una primera dosis de noradrenalina a 0,5 mcgr/kg/min. Al final de este periodo se le llamó "t = 90".
- Treinta minutos después de la fase anterior se incrementó la dosis de noradrenalina al doble (1 mcgr/kg/min). Al final de este periodo se le denominó "t = 120".
- Grupo C (DOPEX) (n = 7): Se trató con otra asociación de aminas. Recibió en primer lugar, tratamiento con dopexamina en infusión continua a dosis de 12 mcgr/kg/min, asociándose posteriormente noradrenalina a dosis e intervalos iguales que en el grupo B.
- 1.- Determinación Basal (BASAL. "t = 0"):
Una vez anestesiado, conectado a ventilación mecánica y canalizadas las diferentes vías, se recogieron las mediciones comentadas; se llamó a este tiempo "t = 0". Inmediatamente después, se inyectó el estímulo séptico. - 2.- Determinación en situación de Shock Séptico (SHOCK. "t = 30"):
A los 10 minutos de terminada la perfusión de la endotoxina y, por lo tanto, a los 30 minutos de la medición en situación basal ("t = 30"), se realizaron las subsecuentes determinaciones hemodinámicas y analíticas. Este momento se escogió como situación de SS. - 3.- Determinación tras inicio de tratamiento con Aminas (DPDB-DX. "t = 60"):
Una vez obtenidas las mediciones en situación de SS, en el grupo A (Grupo control) se continuó con el tratamiento de soporte iniciado, mientras que en los grupos B y C se asoció tratamiento durante 30 minutos con distinta asociación de aminas: (grupo B) dopamina más dobutamina y (grupo C) dopexamina. Esta tercera obtención de datos, se realizó a los 30 minutos del inicio del tratamiento con aminas y a los 60 minutos de la determinación basal, por lo que a esta momento se le denominó "t = 60". - 4.- Determinación tras la asociación de una primera dosis de Noradrenalina (NOR1. "t = 90"):
Tras la medición en "t = 60", se asoció durante 30 minutos, noradrenalina a 0,5 mcg/kg/min al tratamiento anterior en los grupos B y C, mientras que en el grupo A se continuó sin tratamiento con aminas. Esta cuarta determinación, se realizó a los 30 minutos del inicio de la asociación de tratamiento con noradrenalina a las otras aminas y a los 90 minutos de la obtención de las muestras basales, por lo que a esta fase se llamó "t = 90". - 5.- Determinación tras la asociación de Noradrenalina a una segunda dosis (NOR2. "t = 120"):
Por último, se aumentó, durante 30 minutos al doble (1 mcg/kg/min) la dosis de noradrenalina en los grupos B y C, continuando el grupo A sin tratamiento con aminas. Esta quinta extracción de datos se realizó a los 30 minutos de aumentar la noradrenalina y, por tanto, a los 120 minutos de la determinación de los parámetros basales, por lo que se denominó a esta fase "t = 120". - Aumento estadísticamente significativo de: frecuencia cardiaca, hemoglobina y glucemia.
- Descenso estadísticamente significativo de: TAS, TAD, pH, bicarbonato, leucocitos y plaquetas.
- 1/ Evolución intragrupo de las medias de las variables desde el momento "t = 30" hasta la última fase del shock séptico experimental ("t = 120").
- 2/ Diferenciación intergrupo de las variables (según el
distinto tratamiento aplicado), mediante comparación de las medias entre los tres grupos aplicando el análisis de la varianza y entre dos grupos independientes (A-B, A-C, B-C) mediante la "t" de Student.
Con la finalidad de diferenciar si la imposibilidad de demostrar diferencia estadística significativa en la comparación intergrupo, se debía a que realmente no existía esa asociación en la población estudiada o porque aunque existiera dicha asociación no se evidenció porque la muestra estudiada constara de un número insuficiente de sujetos, se calculó la potencia estadística de las variables que presentaban una diferencia clínica valorable o relevante (considerada como una variación > del 20% del valor medio basal) intergrupo.
Si la potencia estadística era alta (> 80%), significaba que existían mínimas posibilidades de que existiera diferencia significativa. Si la potencia estadística era baja (< 80%), se reconocía que se había obtenido una información insuficiente, por lo que no habiendo encontrado una asociación estadística, tampoco permitiera descartarla. Se obtuvieron los siguientes resultados (Tabla 6).
- Evolución intragrupo:
Aumento cronológico progresivo de la glucemia en todos los grupos [excepto en el grupo A en "t = 120", que presentó descenso clínicamente relevante o valorable (variación > 20% de la media global de la variable estudiada en situación basal y que se consideró como valor normal)], generalmente con diferencias clínicamente valorables [excepto en el grupo A en "t = 60" y en el grupo C en "t = 120" que presentaron diferencias no relevantes (< 20% de variación respecto a los valores considerados como normales)]. Esta evolución de la glucemia en cada grupo, estableció la aparición de diferencias estadísticamente significativas entre alguno de los valores medios de glucemia obtenidos entre "t = 30" y "t = 120", en los tres grupos.
- Evolución intergrupo:
En "t = 60", "t = 90" y "t = 120", existió hiperglucemia en los tres grupos, con diferencias clínicamente valorables (diferencias > 20% del valor considerado como normal) intergrupo, pero con potencia estadística alta; lo que significaba que, aceptando un riesgo de error beta reducido, podemos concluir que no existe en nuestro estudio asociación entre el valor de la glucemia y el tratamiento instaurado en cada grupo.
- Evolución intragrupo:
La leucopenia producida por el shock séptico se mantuvo sin cambios relevantes a lo largo del estudio. No obstante, en el grupo B, debido al aumento progresivo del número de leucocitos, se establecieron diferencias estadísticamente significativas entre alguno de los valores medios de los leucocitos medidos durante la evolución del shock séptico experimental; hecho no evidenciado en los otros grupos.
- Evolución intergrupo:
Como se demostró anteriormente, los leucocitos tras la inducción del shock séptico ("t = 30"), no reunieron condiciones de comparabilidad entre los tres grupos, ya que mostraban diferencias significativas entre el grupo A y los grupos B y C. No obstante en "t = 120", se establecieron diferencias clínicamente relevantes entre los grupos A y C, con potencia estadística baja (Tabla 7) (lo que podía significar, si los grupos hubieran sido comparables, que aunque existiera asociación estadística entre el tratamiento instaurado y los leucocitos, la magnitud observada en el estudio no difería significativamente de la hipótesis nula, lo cual estaba en posible relación con una muestra insuficiente).
- Evolución intragrupo:
Una vez desarrollada la plaquetopenia tras la inducción del estímulo séptico, se observó discreto aumento progresivo similar en los tres grupos. Esto originó la aparición de diferencias estadísticamente significativas entre alguna de las medias del recuento plaquetar, medidas en alguno de los momentos de la evolución del shock séptico experimental, en los tres grupos.
- Evolución intergrupo:
Una vez desarrollada la plaquetopenia, por la inducción del shock séptico experimental, se observó elevación progresiva en las fases posteriores, con escasa variación en el comportamiento (sin diferencias clínicamente valorables ni estadísticamente significativas) de las plaquetas intergrupo.
- Evolución intragrupo:
Se pudo apreciar tendencia al descenso progresivo del bicarbonato en los tres grupos (excepto en "t = 90" en el grupo A, en "t = 60" en el grupo B y en "t = 120" en el grupo C) en relación a la progresión del shock séptico. Este descenso fue más evidente en los grupos A y B, evidenciándose diferencias estadísticamente significativas entre algunos de los valores medios de bicarbonato obtenidos en algún momento de la evolución del periodo estudiado en este apartado, en los grupos A y B.
- Evolución intergrupo:
Debido a que el Bicarbonato no reunía criterios de comparabilidad intergrupo ni en situación basal ni tras la inducción del SS, no se analizaron sus resultados.
- Evolución intragrupo:
Se observó un discreto descenso, progresivo, cronológico del pH en todos los grupos, estableciéndose en los tres grupos diferencias estadísticamente significativas, entre algunos de los valores medios de pH medidos en el tiempo de evolución del shock séptco experimental.
- Evolución intergrupo:
Aunque el pH no cumplía criterios de comparabilidad en situación basal, por la acidosis del grupo C respecto a los otros dos grupos, si los cumplía a partir de la inducción del shock séptico. No obstante, no se evidenciaron diferencias clínicamente valorables ni estadísticamente significativas entre los tres grupos.
- Evolución intragrupo:
El comportamiento de la tensión arterial fue diferente según el grupo correspondiente:- - Grupo A (Control): se observó disminución progresiva de la TAS y de la TAD, desde la infusión del estímulo séptico hasta la última fase del estudio, estableciéndose diferencias estadísticamente significativas entre alguna de las medias de la TAS y TAD medida en algún momento de la evolución desde "t = 30" hasta "t = 120".
- Grupo B (DPDB):
- TAS: aumentó con la introducción del tratamiento con dopamina-dobutamina ("t = 60") y con la asociación de noradrenalina a la dopamina-dobutamina ("t = 90" y "t = 120") se consiguió detener la caída de la tensión observada en el grupo control. Se establecieron diferencias estadísticamente significativas entre alguna de las medias de la TAS medida en algún momento de la evolución del shock séptico experimental.
- TAD: aunque no se observó la caída de la TAD evidenciada en el grupo control; no se observaron diferencias estadísticamente significativas intragrupo entre ninguna de las medidas de TAD obtenidas entre algún momento del periodo estudiado.
- Grupo C (DOPEX): se observó tendencia a la disminución de la TAS y de la TAD con el inicio del tratamiento con dopexamina ("t = 60"), mientras que con la asociación de noradrenalina a la dopexamina ("t = 90" y "t = 120") se demostró tendencia hacia el aumento progresivo de ambos parámetros. No se observaron diferencias estadísticamente significativas intragrupo entre ninguna medida de TAS ni TAD realizada en el periodo transcurrido desde "t = 30" hasta "t = 120".
- Evolución intergrupo:
Se evidenció aumento de la TAD en "t = 120", en los grupos tratados con aminas, estableciéndose diferencias estadísticamente significativas en esta fase, entre los grupos B-C y el grupo A. Asimismo se observó distinto comportamiento de los valores tensionales entre diversos grupos y en las diferentes fases, de esta forma se constataron diferencias con relevancia clínica y potencia estadística baja entre los siguientes grupos:
- TAD: en el momento "t = 60" entre los grupos B y C y en el momento "t = 90" entre los grupos B y A.
- TAS: en el momento "t = 120" entre los grupos C y A.
- En el resto de las comparaciones intergrupo, no se establecieron diferencias clínicamente relevantes ni estadísticamente significativas.
- Evolución intragrupo:
Tras la infusión del estímulo séptico, se evidenció aumento progresivo de la frecuencia cardiaca (excepto en "t = 120" del grupo A y C), estableciéndose en los tres grupos diferencias estadísticamente significativas entre alguna media de frecuencia cardiaca medida entre "t = 30" y "t = 120". - Evolución intergrupo:
Se observó mayor taquicardia en los grupos que recibieron tratamiento con aminas; en este contexto se establecieron diferencias clínicamente relevantes y con potencia estadística baja en el momento "t = 60" y diferencias estadísticamente significativas tras la introducción del tratamiento con noradrenalina ("t = 90" y "t = 120"), entre el grupo control y los grupos B-C. - 1.- El estímulo séptico experimental provocó, a lo 30 minutos de su administración, una situación compatible con shock séptico caracterizado por:
- Aumento estadísticamente significativo de: frecuencia cardiaca y glucemia.
- Descenso estadísticamente significativo de: TAS, TAD, pH, bicarbonato, leucocitos y plaquetas.
- 2.- El tratamiento con dopamina a 10 mcg/kg/min y dobutamina a 5 mcg/kg/min produjo:
- Aumento clínicamente valorable con potencia estadística baja de: frecuencia cardiaca, respecto al grupo no tratado con aminas y de la TAD respecto al grupo tratado con dopexamina.
- Variaciones poco importantes respecto a los otros dos grupos de: TAS, glucemia y plaquetas.
- 3.- La adición de noradrenalina a 0,5 mcg/kg/min al tratamiento previo con dopamina-dobutamina produjo:
- Aumento estadísticamente significativo respecto al control de la frecuencia cardiaca.
- Aumento clínicamente valorable con potencia estadística baja de la TAD respecto al grupo control.
- Variaciones poco importantes respecto a los otros dos grupos de: TAS, glucemia y plaquetas.
- 4.- El tratamiento con noradrenalina a 1 mcg/kg/min, asociado a la terapia con dopamina-dobutamina produjo:
- Aumento estadísticamente significativo de: frecuencia cardiaca y TAD, respecto al grupo control.
- Variaciones poco importantes respecto a los otros dos grupos de: TAS, glucemia y plaquetas.
- 5.- El tratamiento con dopexamina a 12 mcg/kg/min produjo:
- Aumento clínicamente valorable con potencia estadística baja de: frecuencia cardiaca, respecto al grupo no tratado con aminas.
- Descenso clínicamente valorable con potencia estadística baja de la TAD respecto al grupo tratado con dopamina-dobutamina.
- Variaciones poco importantes respecto a los otros dos grupos de: TAS, glucemia y plaquetas.
- 6.- La adición de noradrenalina a 0,5 mcg/kg/min al tratamiento previo con dopexamina produjo:
- Aumento estadísticamente significativo respecto al grupo control de la frecuencia cardiaca.
- Variaciones poco importantes respecto a los otros dos grupos de: TAS, TAD, glucemia y plaquetas.
- 7.- El tratamiento con noradrenalina a 1 mcg/kg/min, asociado a la terapia con dopexamina produjo:
- Aumento estadísticamente significativo de la frecuencia cardiaca y TAD, respecto al grupo control.
- Aumento clínicamente valorable con potencia estadística baja de TAS, respecto al grupo control.
- Variaciones poco importantes respecto a los otros dos grupos de: glucemia y plaquetas.
- 8.- Las variables que presentaron cambios significativos en las últimas fases de la investigación experimental, secundarios a la progresión del shock séptico experimental y no a la diferente terapia recibida en cada grupo (ya que se comportaron de forma independiente al tratamiento administrado), fueron: glucosa y plaquetas.
Revisión de Dr. Antonio Núñez Reiz. Medicina Intensiva. Hospital Fundación de Alcorcón, Madrid. España
Revisión de Dr. Ramón Díaz-Alersi. Medicina Intensiva. Hospital Puerto Real, Cádiz. España
RESUMEN
OBJETIVO: Estudiar las variaciones hemodinámicas y metabólicas de las primeras fases del Shock Séptico Experimental (SSE), inducidas por el tratamiento con distinta asociación de aminas.METODO: Investigación experimental en 22 perros. Se les indujo SSE mediante la administración de endotoxina de E. Coli (Serotipo 0111 B.M. Difco Laboratories. Michigan. USA).
En función del tiempo se establecieron 5 fases: Basal ó "t=0" (considerado tiempo 0), SSE ó "t=30" (a los 30 minutos del inicio de la infusión del estímulo séptico), "t = 60", "t = 90" y "t = 120" a los 60, 90 y 120 minutos respectivamente de la administración de la endotoxina. En relación al tratamiento administrado, se distinguieron 3 grupos: Grupo A (n=7): tratamiento de soporte; Grupo B (n=8): Dopamina a 10 mcg/kg/min y Dobutamina a 5 mcg/kg/min (DPDB) en la fase "t=60", DPDB más Noradrenalina (NA) a 0,5 mcg/kg/min (NA0,5) en la fase "t=90"; DPDB más NA a 1 mcg/kg/min (NA1) en la fase "t=120"; Grupo C (n=7): Dopexamina a 12 mcg/kg/min (DX) en la fase "t=60", DX más NA0,5 en la fase "t=90" y DX más NA1 en la fase "t=120".
La comparación estadística se realizó mediante: "t" de Student-Fisher, Análisis de la Varianza, Chi Cuadrado y cálculo de la potencia estadística en caso necesario.
RESULTADOS: Grupo B respecto al A: DP-DB NA0.5 aumentó la Frecuencia cardiaca (FC); DPDB-NA1 además incrementó la Presión diastólica (TAD).
Grupo C respecto al A: DX- NA0,5 aumentó la FC; DX- NA1, incrementó la FC y TAD.
CONCLUSIONES: La FC, TAS y TAD, se modificaron significativamente con las diversas asociaciones de aminas, mientras que no se evidenciaron variaciones intergrupo de la glucemia y plaquetas.
Los cambios significativos en las últimas fases de la investigación experimental, de la glucemia y de las plaquetas, fueron secundarios a la progresión del shock séptico experimental y no a la diferente terapia recibida en cada grupo (ya que se comportaron de forma independiente al tratamiento administrado).
INTRODUCCION
Los cambios hemodinámicos del Shock Séptico (SS), han sido objeto de intensa investigación durante más de 40 años, describiéndose múltiples patrones hemodinámicos1,2,3,4,5,6,7,8,9,10,11,12,13. Estos cambios hemodinámicos se deben entre otras razones a la depresión miocárdica. La disfunción cardiaca se ha explicado por distintas teorías como: 1/ isquemia difusa miocárdica (esta teoría parece no sustentarse tras los estudios de Cunnion y cols14 y Dhainaut y cols15), 2/ factor depresor miocárdico (descrito ampliamente en los estudios de Parrillo y cols16 y Reilly y cols17 y atribuído también a las distintas citoquinas liberadas), 3/ aumento del consumo energético del acoplamiento excitación-contracción 2º al TNF18. También contribuye de forma importante al deterioro hemodinámico, la disminución de la respuesta miocárdica a las catecolaminas debido a la alteración del sistema Beta adrenérgico19 mediado por la generación de AMPc, el cual es responsable de la disfunción miocárdica y de la anómala respuesta miocárdica a las catecolaminas.También se han estudiado los cambios analíticos y metabólicos (secundarios o no a las modificaciones hemodinámicas), que puede inducir el SS y el tratamiento con aminas20,21,22,23, siendo también sus resultados contradictorios.
Esta variabilidad de resultados en los distintos estudios, puede ser debida a la heterogeneidad de los diversos grupos analizados, motivado por la diferente susceptibilidad condicionada por la edad, distinta severidad del estímulo séptico, situación clínica (sedación, analgesia...), etc. Por esta razón, se reune un conjunto homogéneo y comparable de animales de experimentación, a los que se administra un mismo estímulo séptico y se valoran las modificaciones hemodinámicas.
OBJETIVO
Aceptado que en la situación de SS una de las alteraciones más características es el deterioro hemodinámico, nos planteamos como objetivo prioritario del presente trabajo estudiar, una vez desarrollado el SS experimental, la diferente evolución hemodinámica-analítica de los diversos grupos, según reciban (B y C) o no (A) tratamiento con diferente asociación de aminas.MATERIAL y METODOS
Se trata de una investigación experimental en animales, considerando un grupo control, realizada gracias a la financiación concedida por la Beca del FIS 92/0148. Se utilizaron 22 perros adultos de raza Perdiguero de Burgos, del animalario de la Unidad de Investigación del Hospital General Yagüe de Burgos. El estudio fue realizado siguiendo las normas del consejo nacional de investigación respecto al cuidado y uso de animales de laboratorio (Real decreto 88/223).PREPARACION DEL ANIMAL DE EXPERIMENTACION:
Se sedó por vía oral con 25 mg de Maleato de Acepromazina. Una hora más tarde se procedió a inducción anestésica con Tiopental sódico a 30 mg/kg en bolo intravenoso y analgesia con 100 mcgr de Fentanilo intravenoso. El mantenimiento de la hipnosis se realizó con Tiopental sódico intravenoso en perfusión continua a 6 mg/kg/h; la relajación muscular y la analgesia se estableció con Atracurio (15 mg) y Fentanilo (100 mcg) en bolo intravenoso, cada 30 minutos y después de obtener las mediciones hemodinámicas y extraer las muestras correspondientes a cada fase. El aporte hídrico y energético durante el estudio se realizó mediante solución glucosalina a 15 ml/kg/hr.
Una vez anestesiado, se intubó por vía orotraqueal y se conectó a ventilación mecánica con un respirador volumétrico, con aire ambiente, a 14 respiraciones por minuto y volumen corriente de 12 ml/kg, hasta conseguirse una ventilación normocápnica. Durante el experimento no se modificó el reglaje del respirador.
El animal fue situado en decúbito supino, se le implantaron tres electrodos subcutáneos torácicos para monitorización electrocardiográfica y se cubrió con una manta eléctrica. Se canalizaron las siguientes vías:
1.- Vena periférica en extremidad inferior para mantenimiento de hipnosis y aporte hidroelectrolítico.
2.- Vena femoral contralateral a la vena periférica, a través de la vena pudenda, para extracción de muestras y administración del estímulo séptico.
3.- Arteria femoral a partir de una colateral baja para control de la presión arterial y extracción de muestras.Este caréter se conectó, mediante transductores de presión, a un polígrafo Hewlett-Packard Sistema 7754 B para registro continuo.
ESTIMULO SEPTICO:
Se empleó endotoxina de Escherichia Coli (lipopolisacárido complejo extraído de Escherichia Coli, serotipo 0111 B.M.: Difco Laboratories. Michigan. USA). Se administró por vía intravenosa, a una dosis total de 2 mg/kg: 1 mg/kg en bolo y 1 mg/kg diluído en 100 cc de solución salina fisiológica en perfusión durante 20 min.
DESCRIPCION:
Los 22 animales recibieron el estímulo séptico y fueron
divididos en 3 grupos. La selección de los animales para los distintos grupos fue aleatoria y realizada mediante muestreo de casos consecutivos según llegada al laboratorio.
Una vez establecidos los grupos se realizaron en las cinco fases, las siguientes determinaciones analíticas y hemodinámicas: Glucemia, Hemograma (Leucocitos y Plaquetas), gasometría arterial (pH y Bicarbonato), frecuencia cardiaca, TAD y TAS:
METODO ESTADISTICO:
El estudio estadístico de los resultados obtenidos, se ha realizó mediante los paquetes estadísticos Statistical Package for Social Sciencies (SPSS) para Windows, utilizando un ordenador personal compatible.El análisis de comparación de dos muestras se realizó con la "t" de Student-Fisher, aplicando la prueba para grupos independientes y apareados según se compararan los distintos grupos o los distintos tiempos respectivamente y una vez comprobadas las condiciones de aplicación de la prueba. Si las condiciones de aplicación no se cumplían, se utilizaba la prueba no paramétrica "U" de Mann-Whitney. Si la comparación, se realizaba entre más de dos grupos, se aplicaba el análisis de la varianza con la F de Snedecor, y si éste era significativo se utilizaban pruebas o contrastes múltiples (Scheffe o Student-Newmann-Keuls). Si no cumplían las condiciones de aplicación, se empleaba la prueba no paramétrica de Kruskal-Wallis.
La comparación entre los porcentajes se realizó mediante el test de Chi-cuadrado.
El nivel de significación se estableció en 0,05.
Teniendo en cuenta el pequeño tamaño de la muestra, cuando el nivel de significación no se alcanzó con la prueba adecuada y la diferencia podía ser clínicamente valorable, se calculó la potencia de la prueba modificándose ésta y la diferencia a valorar.
RESULTADOS
En las tablas siguientes (Tablas 3-5), se muestran los valores obtenidos en los 22 perros, las medias de las variables de cada grupo y de los tres grupos juntos, en cada uno de los cinco tiempos programados para la extracción y determinación de los parámetros metabólicos y hemodinámicos más relevantes.
Debido al tamaño de la muestra y a la alta variabilidad de los resultados, se muestra esta evolución en forma de "gráfico de caja" ("boxplot")
Aplicando el análisis de la varianza para datos independientes, se demostró la hipótesis de comparabilidad entre los tres grupos (A, B y C) en situación basal y tras indución del SS experimental, en todas las variables excepto: Situación basal: bicarbonato y el pH entre el grupo C y los grupos A-B. Situación de SS experimental: bicarbonato entre el grupo C y los grupos A-B; Leucocitos entre el grupo A y los grupos B-C. Por lo que dichos datos no se expresan en las Tablas.
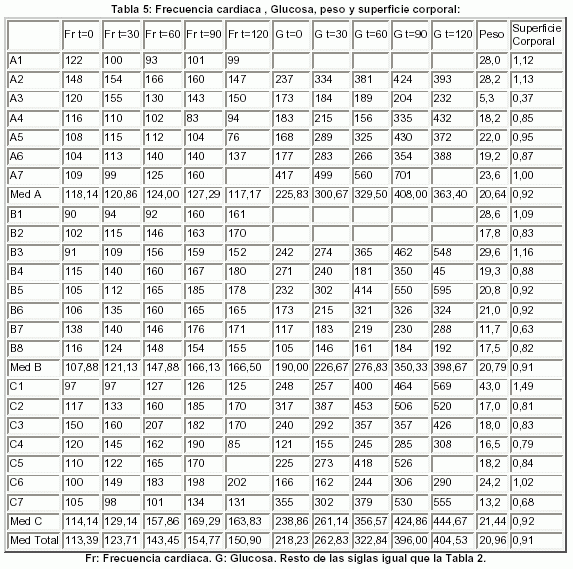
Los cambios obtenidos tras la inducción del shock séptico experimental fueron los siguientes (Tabla 2-5 y Figuras 1-2):
SE ESTUDIÓ:

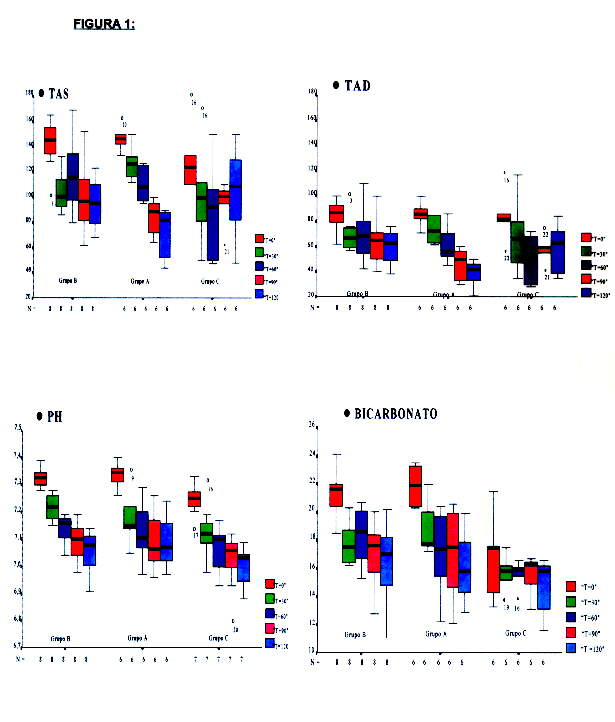
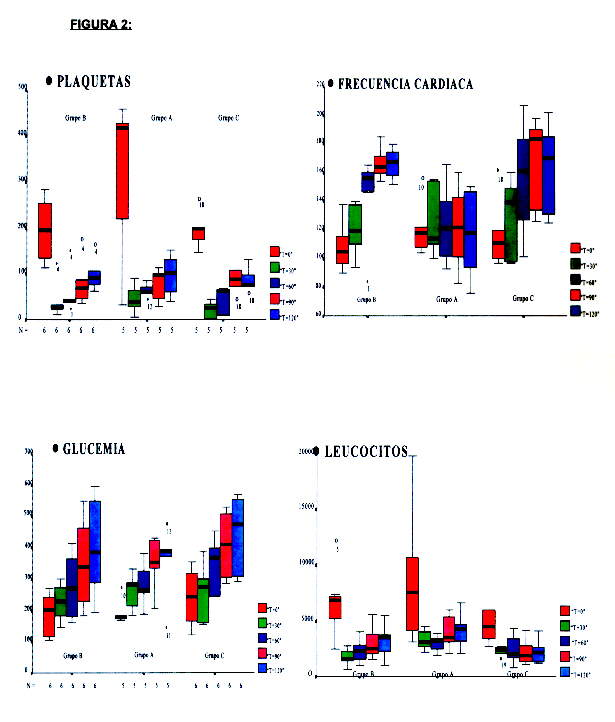
1.- GLUCEMIA: (Tabla 5 y Fig. 1)
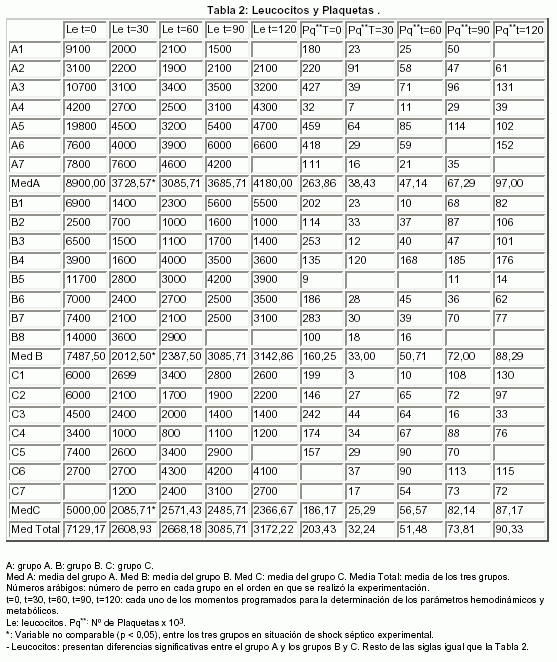
2.- LEUCOCITOS: (Tabla 2 y Fig. 1)
3.- PLAQUETAS: (Tabla 2 y Fig. 1)
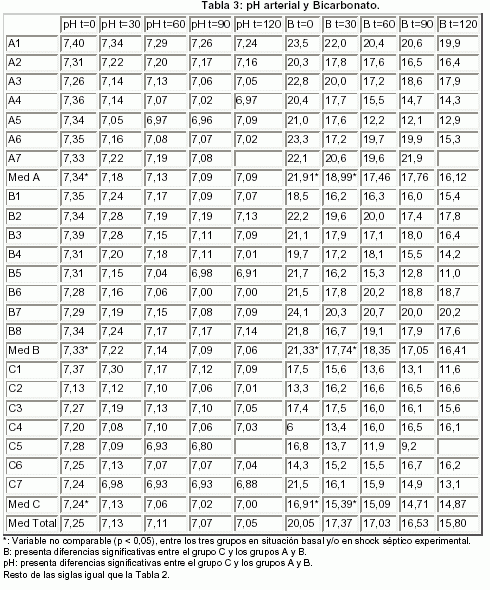
4.- BICARBONATO: (Tabla 3 y Fig. 1)
5.- pH: (Tabla 3 y Fig. 2)
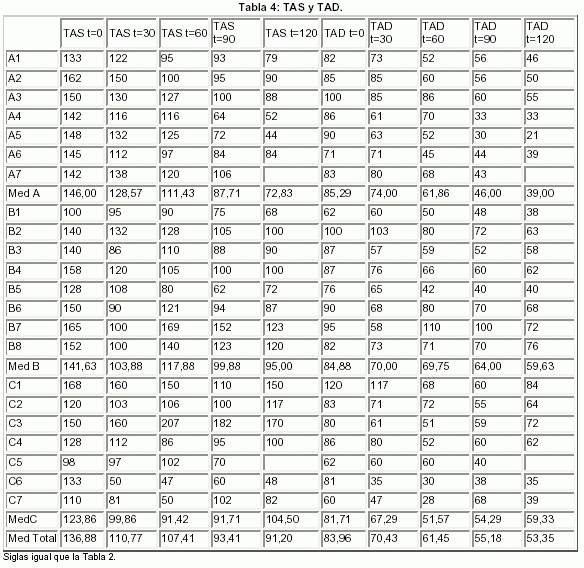
6-7.- TENSIÓN ARTERIAL SISTóLICA Y DIASTÓLICA (TAS Y TAD): (Tabla 4 y Fig. 1)
8.- FRECUENCIA CARDIACA: (Tabla 5 y Fig. 1):
DISCUSION
1.- GLUCEMIA:
El aumento de la glucemia tras la inducción del SS experimental y el posterior aumento cronológico en los tres grupos, pudo explicarse por la estimulación adrenérgica del estímulo séptico que acelera la glucogenolisis28.
En este trabajo, no se evidenciaron variaciones significativas entre los tres grupos y, a pesar de que existió mayor hiperglucemia en el grupo C, las diferencias clínicamente valorables (diferencia > 20% del valor medio obtenido en situación basal, el cual se consideró como el valor normal) observadas intergrupo, en "t = 60", "t = 90" y "t = 120", presentaron una potencia estadística alta; lo que significaba que, aceptando un riesgo de error beta reducido, podíamos concluir que no existía en nuestro estudio asociación entre el aumento de la glucemia y el tratamiento instaurado en cada grupo.
Por lo tanto no se evidenció un comportamiento diferente de la glucemia en relación a la administración o no de alguna de las asociaciones de aminas (como es sabido, el cambio en la concentración de glucosa plasmática secundario a la acción beta-2 adrenérgica, se evidencia sobre todo con la infusión de adrenalina, isoproterenol, dopamina, terbutalina y salbutamol; la dopexamina a patir de dosis > 3 mcg/kg /min, también produce hiperglucemia), por lo que la hiperglucemia aparecida en nuestro estudio se deberá relacionar con la estimulación adrenérgica del estímulo séptico administrado y no con el tratamiento con las diversas aminas.
2.- LEUCOCITOS:
En investigación animal, se ha comprobado que la inyección de la endotoxina, produce un cuadro que puede incluir neutropenia, junto con otros síntomas que simulan el shock séptico. En nuestra investigación experimental, también se indujo leucopenia con el estímulo séptico, que se mantuvo a lo largo del estudio. Como se demostró anteriormente, los leucocitos tras la inducción del shock séptico, no reunieron las condiciones de comparabilidad entre los tres grupos (ya que mostraban diferencias significativas entre el grupo A y los grupos B y C en "t = 30"), por lo que no se obtuvieron conclusiones de la comparación intergrupo.
Asimismo, está descrito que el tratamiento con diversas aminas puede alterar cuantitativa y cualitativamente los leucocitos, suceso que no hemos evidenciado en nuestro trabajo.
3.-PLAQUETAS:
Se ha descrito que el shock séptico puede inducir plaquetopenia, hecho que observamos de forma muy evidente en nuestro estudio. Una vez desarrollada la plaquetopenia, por la inducción del shock séptico experimental, se constató una elevación progresiva en las fases posteriores. A pesar de que se conoce que algunos fármacos inotrópicos pueden influir en determinadas características hematológicas como la función plaquetar (por ejemplo la noradrenalina puede promover la agregación plaquetar y otros fármacos beta-adrenégicos, pueden desarrollar una leve trombocitopenia), estas acciones no se evidenciaron en este trabajo, obteniéndose escasa variación en el número de plaquetas (sin diferencias clínicas relevantes ni estadísticamente significativas) intergrupo.
4.- BICARBONATO:
La acidosis metabólica con descenso del bicarbonato, debida al metabolismo anaerobio por la mala distribución de la perfusión de los tejidos ocurrida en el shock séptico, también fue objetivada en nuestra investigación experimental. Estudiando los resultados obtenidos, se pudo apreciar una tendencia cronológica al descenso del bicarbonato en todos los grupos (excepto en "t = 90" en el grupo A, en "t = 60" en el grupo B y en "t = 120" en el grupo C). Sin embargo, como se demostró anteriormente, el bicarbonato era una variable que no cumplía criterios de comparabilidad intergrupo ni en situación basal ni tras la inducción del shock séptico, por lo que no se pudieron obtener más conclusiones en este apartado. Esta característica de no comparabilidad es probable que se encontrara en relación con el posible sesgo producido por las colas de distribución que se situaban muy alejadas (longitud de las patillas del gráfico) y por la presencia de un valor "anómalo o alejado" en el perro 19.
5.- pH:
Se observó un discreto descenso progresivo cronológico del pH en todos los grupos, estableciéndose en los tres grupos diferencias estadísticamente significativas entre algunos de los valores medios de pH medidos en el tiempo de evolución del shock séptico experimental.
El motivo de la acidosis metabólica del shock séptico y por lo tanto también del descenso del pH observado en nuestro estudio tras la infusión del estímulo séptico, se debe al metabolismo anaerobio resultante de la mala distribución de la perfusión de los tejidos que produce acidosis intracelular y extracelular. Aunque el pH no cumplía criterios de comparabilidad intergrupo en situación basal por la acidosis del grupo C, en probable relación con el sesgo producido por el valor anómalo del perro 17, respecto a los otros dos grupos, si los cumplía a partir de la inducción del shock séptico. Se observó un descenso progresivo cronológico del pH en los tres grupos, sin evidenciarse diferencias clínicamente relevantes ni estadísticamente significativas entre los tres grupos.
Esta acidosis metabólica progresiva, que no fue corregida médicamente ni compensada con hiperventilación en la investigación experimental, pudo haber influído en la magnitud del efecto de las diversas aminas empleadas.
6 - 7.-TAS y TAD:
La sepsis puede complicarse con hipotensión y shock (shock séptico) y la muerte suele suceder debido a hipotensión refractaria o a SFMO. El mecanismo de esta hipotensión, se debe a los cambios de la función cardiovascular1,2,19. Por lo tanto, el modelo experimental de shock séptico ha de reproducir los cambios encontrados en pacientes con esta condición. Ya en el año 1956, se comunicó que la administración intravenosa de endotoxina en perros inducía hipotensión secundaria a una disminución del volumen minuto. De forma similar a éstos y otros estudios, todos los grupos de nuestra investigación experimental, presentaron caída importante de la tensión arterial (con diferencia estadística significativa respecto a la situación basal) tras la infusión del shock séptico. Posteriormente, la evolución fue diferente en relación al tratamiento instaurado en cada grupo:
- Grupo A (Control). Se observó disminución progresiva de la TAS y de la TAD, desde la inducción del estímulo séptico hasta la última fase del estudio, en relación con el efecto vasodilatador y depresor cardiaco de los radicales liberados en el shock séptico.
- Grupo B (DPDB). Se evidenció tendencia a frenar la caída de la TAS observada en el grupo control. Sin embargo la evolución de dicha variable, no estableció diferencias clínicamente relevantes ni estadísticamente significativas respecto a los otros dos grupos; este comportamiento tal vez pueda explicarse porque el efecto alfa-adrenérgico que posee la dopamina a la dosis empleada fue compensado por el efecto vasodilatador beta-adrenérgico de la dobutamina, porque la acción alfa-adrenérgica de la noradrenalina6,25,26 estuviera también compensada por la dobutamina y además la acción de la noradrenalina estuviera interferida por la acidosis metabólica presente y por la disminución de la estimulación beta-adrenérgica del AMPc propia del shock séptico, lo que se asoció con una disminución de la capacidad de respuesta miocárdica y vascular a las catecolaminas.
Respecto a la TAD, también se observó tendencia a frenar la caída de la TAD evidenciada en el grupo control. En esta variable, en "t = 60", debido a los efectos explicados de la dopamina-dobutamina añadido al efecto depresor del IRVS (secundario a la acción agonista beta-2) de la dopexamina, si se pudo apreciar un aumento con relevancia clínica y potencia estadística baja de la TAD en el grupo B respecto al C (lo que no descartaba la posibilidad de que debido al pequeño tamaño de la muestra no se hubieran objetivado diferencias estadísticamente significativas). En "t = 90" y en "t = 120" también se evidenció mayor TAD en el grupo B que en el A, estableciéndose diferencias con relevancia clínica y potencia estadística baja entre estos dos grupos en "t = 90", alcanzando esta diferencia en "t = 120" significación estadística.
Al igual que lo comentado en la TAS, en las dos últimas fases del shock séptico experimental, el efecto de las aminas pudo haber estado interferido por la acidosis metabólica presente y por la disminución de la estimulación beta-adrenérgica propia del shock séptico19,26,27, hechos que tal vez impidieran una mayor diferenciación entre los grupos tratados con aminas y el grupo control.
- Grupo C (DOPEX). A diferencia del grupo B, en "t = 60", debido a que la dopexamina (por su efecto agonista beta-2 y ningún efecto sobre los receptores alfa) tiene efecto depresor del IRVS, se pudo apreciar una tendencia al descenso de la TAS respecto a los otros dos grupos (aunque sin evidenciarse diferencias clínicamente valorables ni estadísticamente significativas intergrupo) y un descenso de la TAD, que se constató con el establecimiento de diferencias con relevancia clínica y potencia estadística baja (lo que no descartaba que no se hubieran objetivado diferencias intergrupo estadísticamente significativas por el pequeño tamaño de la muestra), entre el grupo C y el B. Con la asociación de noradrenalina a 0,5 mcg/kg/min a la dopexamina (a pesar de la acidosis ya presente y la disminución de la estimulación beta-adrenérgica presente en el shock séptico), secundario a la acción alfa-adrenérgica de la noradrenalina18, se produjo una tendencia al aumento de la TAS y TAD respecto al grupo control, aunque sin objetivarse diferencias clínicamente valorables.
Con la asociación de noradrenalina a 1 mcg/kg/min, se evidenció aumento en la TAD, estableciéndose diferencias estadísticamente significativas entre el comportamiento de dicha variable en los grupos B-C y en el grupo A; también se pudo observar un aumento de la TAS, que se demostró con la aparición de diferencias con relevancia clínica y potencia estadística baja, en el momento "t = 120", entre el grupo C y el A.
8.- FRECUENCIA CARDIACA:
En nuestro trabajo, tras la inducción del shock séptico experimental también se evidenció aumento estadísticamente significativo de la frecuencia cardiaca, que se mantuvo a lo largo del resto de las fases del estudio (excepto en "t = 120" del grupo A y C). La taquicardia fue mayor en los grupos que recibieron tratamiento conaminas, lo que se constató con la aparición de diferencias estadísticamente significativas tras la introducción del tratamiento con noradrenalina ("t = 90" y "t = 120") entre la frecuencia cardiaca evidenciada en los grupos B-C y la medida en el grupo control; asimismo se objetivó un aumento clínicamente relevante (diferencia > del 20% del valor considerado como normal) y con potencia estadística baja en el momento "t = 60" entre el valor de dicha variable en los grupos B-C y el grupo A, lo que significa que, aunque si pudo existir asociación estadística entre el tratamiento con dopamina-dobutamina o dopexamina y el aumento de la frecuencia cardiaca, no se demostró en este estudio en posible relación con una muestra insuficiente.
En el grupo B, en la fase "t = 60", a pesar de que la dobutamina ejerce un efecto moderado cronotrópico (ya que aunque el receptor adrenérgico cardiaco predominante es el beta-1, existe un receptor alfa-1 cardiaco que estimula la contractilidad sin alterar la frecuencia24) que no justifica el posible aumento de la frecuencia cardiaca, su asociación en esta fase con la dopamina (con su conocido efecto cronotrópico), si la puede justificar. De igual forma, se sabe que la dopexamina posee escaso efecto taquicárdico "per se", sin embargo la frecuencia cardiaca puede aumentar por el efecto reflejo secundario a la vasodilatación, lo cual puede explicar un aumento de dicha variable en el grupo de perros tratados con dopexamina. Asimismo, está descrito que la noradrenalina (debido a su acción vasoconstrictora) provoca una actividad vagal refleja que neutraliza en parte la taquicardia derivada de la estimulación simpática y puede no justificar por si misma la taquicardia.
Sin embargo, el moderado efecto taquicardizante de todas estas aminas se suman en las fases "t = 90" y "t = 120", influyendo en esta variable y produciendo más taquicardia que en el grupo control. Este efecto taquicardizante de las aminas, se debe a que se produce aceleración de la despolarización espontánea de las células sinoatriales, aceleración de la despolarización diastólica, facilitación de la activación de las células marcapasos latentes, así como acortamiento del período refractario de las células musculares auriculares y ventriculares, produciendo aumento de la velocidad de conducción.
En el grupo B, en la fase "t = 60", a pesar de que la dobutamina ejerce un efecto moderado cronotrópico (ya que aunque el receptor adrenérgico cardiaco predominante es el beta-1, existe un receptor alfa-1 cardiaco que estimula la contractilidad sin alterar la frecuencia) que no justifica el posible aumento de la frecuencia cardiaca, su asociación en esta fase con la dopamina (con su conocido efecto cronotrópico), si la puede justificar. De igual forma, se sabe que la dopexamina posee escaso efecto taquicárdico "per se", sin embargo la frecuencia cardiaca puede aumentar por el efecto reflejo secundario a la vasodilatación, lo cual puede explicar un aumento de dicha variable en el grupo de perros tratados con dopexamina.
Asimismo, está descrito que la noradrenalina (debido a su acción vasoconstrictora) provoca una actividad vagal refleja que neutraliza en parte la taquicardia derivada de la estimulación simpática y puede no justificar por si misma la taquicardia. Sin embargo, el moderado efecto taquicardizante de todas estas aminas se suman en las fases "t = 90" y "t = 120", influyendo en esta variable y produciendo más taquicardia que en el grupo control.
CONCLUSIONES
-
A partir de la investigación experimental expuesta, basada en la infusión de un estímulo séptico en animales de experimentación y administración posterior de diversas aminas, podemos llegar a las siguientes conclusiones:
BIBLIOGRAFIA:
1.- Waisbrein BA. Bacteriemia due to gram-negative bacilli other than Salmonella. A clinical and therapeutic study. Arc Intern Med 1951;88:467-488.2.- Weil MH, MacLean LD, Visscher MB, Spink WW. Studies on the circulatory changes in the dog produced by endotoxin from gram negative micro-organims. J Clin Invest 1956;35:1191-1198.
3.- Nishijima H, Weil MH, Shubin H. Hemodynamic and metabolic studies on shock associated with gram negative bacteriemia. Medicine 1973;52:287-294.
4.- Wilson RF, Thal AP, Kindling PH. Hemodynamic measurements in septic shock. Arch Surg 1965;91:121-129.
5.- D’Orio V, Fossion A, Ferir A, Juchmes J, Marcelle R, Limet R. Arch Int Physiol Biochim 1983;91(4):261-7.
6.-Hannemann L, Reinhart K, Grenzer O, Meier-Hellmann A, Bredle DL. Comparison of dopamine to dobutamine and norepinephrine for oxygen delivery and uptake in septic shock. Crit Care Med 1995;23:1962-1970.
7.- Astiz ME, Rackow EC, Falk JL, Kaufman BS, Weil MH. Oxygen delivery and consumption in patients with hyperdynamic septic shock. Crit Care Med 1987;15(1):26-8.
8.- Bone RC, Grodzin CJ, Balk RA. Sepsis: A New Hypotesis for Pathogenesis of the Disease Process. Chest 1997;112:235-243.
9.- Dorinsky PM. The sepsis Syndrome. Clinics in Chest Medicine 1996;17:175-353.
10.-Van Lambalgen AA, Bronsveld W, Van Den Bos GC, Thijs LG. Distribution of cardiac output, oxygen consumption and lactate production in canine endotoxin shock. Cardiovasc Res 1984;18:195-205.
11.- Cronenwett JL, Lindenauer SM. Direct measurement of arteriovenous anastomotic blood flow in the septic canine hindlimb. Surgery 1979;85:275-282.
12.- Archie JP. Anatomic Arterial-venous Shunting in Endotoxic and Septic Shock in Dogs. Ann Surg 1977;186:171-176.
13.- Hussain SNA, Rutledge F, Graham R, Magder S, Roussos C. Effects of norepinephrine and fluid administration on diaphragmatic O2 consumption in septic shock. J Appl Physiol 1987;62:1368-1376.
14.- Cunnion RE, Schaer GL, Parker MM, Natanson C, Parrillo JE. The coronary circulation in human septic shock. Circulation 1986;73:637-644.
15.- Dhainaut JF, Huyghebaert MF, Monsallier JF, Lefevre G, Dall'Ava-Santucci J, Brunet F, et al. Coronary hemodynamics and myocardial metabolism of lactate, free fatty acids, glucose, and ketones in patients with septic shock. Circulation 1987;75:533-541.
16.- Parrillo JE, Burch C, Shelhamer JH, Parker MM, Natanson C, Schuette W. A circulating myocardial depressant substance in humans with septic shock. J Clin Invest 1985;76:1539-1553.
17.- Reilly JM, Cunnion RE, Burch-Whitman C, Parker MM, Shelhamer JH, Parrillo JE. A circulating myocardial depressat substance is associated with cardiac dysfuntion and peripheral hypoperfusion (lactic acidemia) in patients with septic shock. Chest 1989;95(5):1072-80.
18.- Miyano H Shishido T, Kawada T, Miyashita H, Sato T, Sugimachi M. Acute effect of tumor necrosis factor-alfa is minimal on mechanics but significant on anergetics in blood-perfused canine left ventricles. Crit Care Med 1999;27(1):168-176.
19.- Silverman HJ, Penaranda R, Orens JB, Lee NH. Impaired betaadrenergic receptor stimulation of cyclic adenosine monophosphate in human septic shock: association with myocardial hyporesponsiveness to catecholamines. Crit Care Med 1993; 21:31-39.
20.- Bakker J, Coffernils M, Leon M, Gris P, Vincent JL. Blood lactate levels are superior to oxygen-derived variables in predicting outcome in human septic shock. Chest 1991;99:956-962.
21.- Haupt MT, Gilbert EM, Carlson RW. Fluid Loading Increases Oxygen Consumption in Septic Patients with Lactic Acidosis. Am Rev Respir Dis 1985;131:912-916.
22.- Cain SM, Curtis SE: Systemic and regional oxygen uptake and lactate flux in endotoxic dogs resucitated with dextran and dopexamine or dextran alone. Circ Shock 1992;38:173-181.
23.- Colardyn FA, Vandenbogaerde JF: Use of dopexamine hydrochloride in intensive care patients with low-output left ventricular heart failure. Am J Cardiol 1988;62:68C-72C.
24.- Mohsenifar A, Goldbach P, Tashkin DP, Campisi DJ. Relationship between O2 delivery and O2 consumption in the adult respiratory distress syndrome. Chest 1983;84:267-271.
25.- Kreuzer F, Cain SM: Regulation of peripheral vasculature and tissue oxygenation in health and disease. Crit Care Clin 1985;1:453-470.
26.- Bakker J, and Vicent JL. Effects of norepinephrine and dobutamine on oxigen transport and consumption in a dog model of endotoxic shock. Critical Care Medidcine 1993;1826-1831.
27.- Nordin A, Mäkisalo H, Mildh L, Höckerstedt K. Dopexamine improves liver oxygenation during crystalloid resuscitation from experimental hemorragic shock. Crit Care Med 1997;25:663-668.
28.- Nelson DP, Samsel RW, Wood LDH, Schumacker PT. Phathological supply dependence of systemic and intestinal O2 uptake during endotoxemia. J Appl Physiol 1988;64:2410-2419.
Comentario de Dr. Antonio Núñez Reiz. Especialista en Medicina Intensiva. Hospital Fundación de Alcorcón. Madrid. España
El tratamiento del shock séptico sigue siendo hoy en día objeto de importante controversia a la hora de valorar el papel a jugar por los distintos fármacos que pueden utilizarse. La variabilidad interindividual y la ausencia de grandes series clínicas de pacientes homogéneos no permiten dilucidar cual es el régimen óptimo a utilizar.
El presente estudio experimental describe la respuesta de una serie de parámetros hemodinámicos y analíticos en perros sometidos a un shock séptico inducido por la administración de endotoxina de Escherichia Coli. En concreto, se compara un grupo control con dos grupos en los que se emplean regímenes distintos de tratamiento (en concreto dopamina más dobutamina y posteriormente noradrenalina más dobutamina, frente a dopexamina posteriormente complementada con noradrenalina).
El estudio pretende reducir en lo posible la variabilidad observada en investigaciones previas al reducir la población a una muestra lo más homogénea posible, eso sí, dentro del entorno experimental, con las limitaciones que esto supone para la práctica clínica.
Aunque el tamaño muestral del estudio no permite extraer conclusiones definitivas, si arroja cierta luz sobre aspectos interesantes del cuadro:
1)la evolución de algunos parámetros, como la glucemia y el pH, es bastante independiente del régimen terapéutico empleado. A pesar de la mejoría de alguno de los parámetros hemodinámicos, estos parámetros parecen seguir un devenir negativo independiente.
2) El régimen con dopamina y dobutamina y posteriormente con noradrenalina y dobutamina proporciona una menor disminución de los parámetros relacionados con las resistencias periféricas, que mejoran la evolución sin tratamiento con respecto a estos parámetros. La frecuencia cardiaca presenta la evolución esperable al tratarse de un tratamiento con catecolaminas.
Estudios de este tipo permiten explorar dentro de un entorno controlado distintos regímenes terapéuticos, y pueden ir añadiendo información relevante que nos permita mejorar el manejo clínico de los pacientes con shock séptico, que hoy en día todavía mantiene cifras altas de mortalidad.
Comentario de Dr. Ramón Díaz-Alersi. Especialista en Medicina Intensiva. Hospital Puerto Real. Cádiz. España
En el shock séptico suele existir una hipotensión arterial sistémica a pesar de un gasto cardiaco elevado. Esta hipotensión suele ser refractaria al tratamiento con expansión de volumen. En estas condiciones es inevitable el uso de sustancias vasopresoras para aumentar la predión arterial a unas cifras aceptables, las usadas habitalmente son todas aminas de acción simpaticomimética como la noradrenalina, la adrenalina, la dopamina a dosis vasoconstrictoras o la dopexamina. En ocasiones se asocian a otra maina, la dobutamina, de potente efecto inotrópico, en un intento de mejorar la contractilidad cardiaca que se supone deteriorada por el estado de shock.
El fundamento para el uso de agentes vasopresores en el shock séptico está basado en el conocimiento de la existencia de una autorregulación de todas las circulaciones regionales que hace que si el gasto cardiaco se mantiene, el flujo de los distintos órganos se mantiene constante con tal de que la prwsión arterial tenga un valor mínimo, cuando la presión cae por debajo de ese valor umbral, el flujo de los órganos disminuye de una forma lineal, llegando a producir isquemia y, como consecuencia, insuficiencia orgánica. Por ello, un objetivo fundamental en el tratamiento de los estados de shock es la restauración y mantenimiento de una presión arterial adecuada, dicho objetivo se intenta conseguir en primer lugar con la expansión de volumen y, una vez garantizada una adecuada expansión, mediante el uso de vasopresores.
En el shock séptico la amina más usada es la noradrenalina, sola o en combinación con otras como la dobutamina y la dopamina. Una menos usada es la dopexamina. A lo largo de los últimos 30 años, esas amina han permanecido en el arsenal terapéutico del intensivista, conm la única modificación de los protocolos de uso, que han variado a medida que aumentaban nuestros conocimientos sobre la fisiopatología del shock y que se daban a conocer nuevos estudios clínicos con esas drogas.
La utilización de medicacion vasopresora, que actúa o puede actuar produciendo vasoconstricción en ciertos lechos vasculares, no deja de tener sus peligros en una situación de shock en la que ya existe una hipoperfusión tisular. Las aminas simpaticomiméticas tienen también otros efectos, metabólicos principalmente, que deben ser tenidos en consideración cuando se emplean.
En el artículo experimental incluido en este número, Zabalegui y col. detallan los efectos de varias combinaciones de aminas en los parámetros hemodinámicos y metabólicos de perros a los que se ha inducido un shock séptico. Se observa un efecto bastante homogéneo sobre la presión arterial, mientras que los valores metabólicos (glucemia y pH) no perecen alterarse.
