Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
INSUFICIENCIA RENAL AGUDA CON UREA PLASMATICA NORMAL: Un Marcador de Disfunción Tubular Proximal y Diabetes Insípida
Caso Clínico
Musso CG1, 2, Giordani C1, Stonski E2, Peralta M2,
Bonetto A2, Jauregui R2, Algranati L1
1 Servicio de Nefrología y 2Centro Agustin Rocca
Hospital Italiano de Buenos Aires-Argentina
Rev Electron Biomed / Electron J Biomed 2004;2:69-73.
Comentario del Dr Omar Abboud. Consultant Nephrologist, Hamad Medical Corporation, Doha, Qatar.
Comentario del Dr. Jesús Garrido. Unidade de Nefrologia e Diálise. Hospital São Teotónio de Viseu. Viseu. Portugal.
Aproximadamente 8% a 26% de los pacientes que reciben un aminoglucósido por un período mayor a varios días, desarrollan una insuficiencia renal leve que suele ser casi siempre reversible.
En este reporte describimos el caso una paciente mujer de 23 años en tratamiento con amikacina que presentó una insuficiencia renal aguda con poliuria acuosa, excreción fraccional de urea elevada y uremia normal, sin justificarse esto último por la presencia de hepatopatía, desnutrición, contextura corporal pequeña ni dieta vegetariana. Los aminoglucósidos pueden alterar el funcionamiento de los túbulos proximales, los mecanismos de concentración urinaria y la respuesta del nefrón distal a la vasopresina. Esto último podría explicar la presencia de una uremia normal en el contexto de una insuficiencia renal aguda, como el resultado de una marcada excreción urinaria de urea. La insuficiencia renal aguda con uremia normal, en paciente joven y no desnutrido, podría ser un marcador de disfunción tubular proximal con diabetes insípida.
Aproximadamente 8% a 26% de los pacientes que reciben un aminoglucósido por un período mayor a varios días, desarrollan una insuficiencia renal leve que suele ser casi siempre reversible. La toxicidad por aminoglucósidos es producto de la acumulación y retención de dicha droga en los túbulos renales proximales 1.
En el siguiente caso describiremos un curioso patrón de insuficiencia renal aguda documentado en un paciente tratado con el aminoglucósido amikacina.
CASO CLÍNICO
Nos fue solicitado evaluar a una paciente mujer de 23 años por presentar insuficiencia renal aguda con urea plasmática normal. No era hepatópata ni poseía reducción significativa de su masa muscular. Tampoco era vegetariana y sus parámetros nutricionales eran normales, siendo su talla y peso de 1,64 m y 61 kg respectivamente.
Tres meses antes de su internación en nuestro hospital había sufrido una fractura de su primera y cuarta vértebras lumbares como consecuencia de un accidente de tránsito. Se le realizó una cirugía para estabilizar la columna vertebral. Desafortunadamente desarrolló un abseso en la herida quirúrgica. Fue entonces derivada a nuestro hospital donde tuvo que ser reintervenida quirúrgicamente. En dicha cirugía fueron tomadas muestras de hueso para estudio patológico y cultivo. Estos estudios confirmaron el diagnóstico de osteomielitis aguda secundaria a Pseudomona Aeruginosa y Stafilococcus Aureus meticilina-resistente.
Un esquema antibiótico compuesto por vancomicina 2 gramos/día, amikacina 1 gramo/día y piperacilina 16 gramos/día fue prescripto. Luego de 1 mes de tratamiento fue detectado un aumento en la creatinina plasmática: 1.2 mg/dl (siendo su valor basal 0.9 mg/dl). La insuficiencia renal aguda tenía un patrón no oligoanúrico (diuresis 4000 cc/día), con orina hipotónica (210 mOsm/l). A raíz de la presencia de insuficiencia renal aguda el esquema antibiótico fue rotado a uno no nefrotóxico y muestras de sangre y orina fueron tomadas diariamente a fin de monitorizar los valores de urea y creatinina.
Se detectó un aumento progresivo en los niveles de creatininemia sin una alteración significativa en los de uremia. Incluso el valor de uremia más bajo (22 mg/dl) fue detectado en el momento en que la paciente tenía su creatininemia más elevada (2.6 mg/dl) (Tabla I).
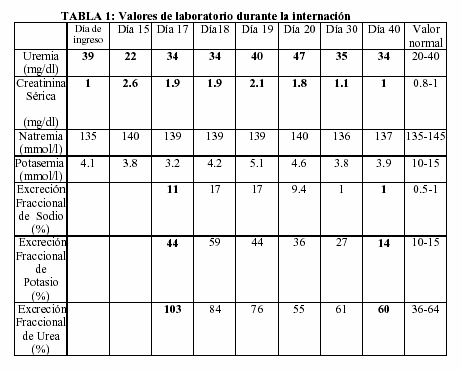
Con el objetivo de explicar este fenómeno, fueron medidos en sangre y orina creatinina y urea a fin de poder calcular la excreción fraccional de urea (EFU). Como se puede apreciar en la Tabla I, la EFU fue muy alta (EFU: 103%), significando que esta sustancia era excretada en grandes cantidades, fenómeno que explicaría nuestro hallazgo de urea plasmática normal en el contexto de una insuficiencia renal aguda.
A partir de que las drogas nefrotóxicas fueron removidas la insuficiencia renal mejoró progresivamente normalizando su creatininemia.
DISCUSIÓN
La insuficiencia renal aguda antes descripta podría haber sido provocada por dos causas potenciales: la osteomielitis aguda y los antibióticos nefrotóxicos. Sin embargo, si se tiene en cuenta que el deterioro renal comenzó después de su uso, y su remoción condujo a la recuperación del fracaso renal, dichos antibióticos pueden ser considerados los principales causantes de la insuficiencia renal. A pesar de que los tres antibióticos son potencialmente nefrotóxicos 2, la amikacina, un aminoglucósido, es el más nefrotóxico de todos ellos 3.
El aminoglucósido es excretado por filtración glomerular, aunque un pequeño porcentaje de la droga filtrada es reabsorbida en los túbulos proximales. Esta reabsorción es hecha por pinocitosis a través de la superficie apical de las células tubulares proximales. Una vez en el interior de la célula, el aminoglucósido perturba la integridad de las mitocondrias y los lisosomas 4, 5. La toxicidad por estos antibióticos está mediada por mecanismos tanto necróticos, como no necróticos (apoptóticos) 5. La acumulación de esta droga en la corteza renal puede alcanzar concentraciones que exceden los niveles séricos hasta unas siete veces, siendo precisamente esta acumulación tisular la base de la toxicidad tubular proximal de la droga 3.Sin embargo, se ha descripto una disociación entre dicha acumulación tisular y la preservación de la función renal 4.
Los aminoglucósidos pueden también alterar los mecanismos de concentración urinaria, así como la respuesta de los túbulos colectores a la vasopresina3.Lo antes mencionado explica claramente la poliuria acuosa (hipoosmolar) documentada en esta paciente.
El punto central en este caso clínico es la presencia de una insuficiencia renal aguda con urea plasmática normal, no explicable por reducción de la masa muscular, ya que la paciente no era desnutrida, anciana, ni de pequeña contextura corporal.
Bajo condiciones fisiológicas normales, alrededor del 50% de la urea filtrada es reabsorbida en los túbulos contorneados proximales. Parte de la urea restante debe ser reabsorbida en la nefrona cortical distal. Dado el alto flujo sanguíneo cortical y la organización vascular y tubular de esta área, parece poco probable que la urea ya reabsorbida sea restituida a la luz tubular. Al menos 50% de la urea filtrada no puede ser excretada, por lo cual una excreción fraccional de urea (EFU) mayor del 50% podría significar la presencia de un defecto en la reabsorción de urea o su secreción. Como la principal reabsorción de urea se lleva a cabo en el túbulo proximal, zona preponderantemente afectada por la amikacina, una reducción en la reabsorción proximal de urea podría explicar en parte la elevada EFU documentada en esta paciente 6, 7, 8. La coexistencia de una elevada excreción fraccional de sodio y potasio refuerza la hipótesis de un mecanismo defectuoso de reabsorción tubular en este caso.
Además, dado que el incremento en el flujo urinario es otra causa de aumento en la excreción de urea por disminución de su reabsorción distal, la diuresis acuosa de esta paciente producto de la diabetes insípida nefrogénica inducida por amikacina, puede también explicar su elevada EFU6.
Con respecto a la creatininemia esta no sólo estaría elevada como consecuencia de su menor filtración (insuficiencia renal), sino además por reducción de su secreción producto de la disfunción tubular proximal secundaria a amikacina.
CONCLUSIÓN
La insuficiencia renal aguda con uremia normal, en paciente joven y no desnutrido, podría ser un marcador de disfunción tubular proximal con diabetes insípida.
REFERENCIAS:
-
1.- Chambers H. The aminoglycosides. In Goodman Gilman A, Limbird LE, Hardman JG (Eds). The pharmacological basis of therapeutic. New York. Medical Publishing Division. 2002: 1229
2.- Lacy C, Armstrong L, Goldman M, Lance L. Drug information handbook Hudson. Lexi-Comp; 2003: 1115-1116.
3.- Ahijado FJ, Garcia S. Nephrotoxic Acute Renal Failure. In Liaño F, Pascual J. (Eds). "Acute renal failure". Barcelona. Masson.2000: 139-170.
4.- Swan S, Bennett W. Nephrotoxic acute renal failure. In Lazarus JM, Brenner BM (Eds).Acute renal failure. New York. Curchill Livingstone. 1993: 361-4.
5.- El Mouedden M, Laurent G, Mingeot-Leclercq MP, Taper H, Cumps J, Tulkens. Apoptosis in renal proximal tubules of rats treated with low dosis of aminoglycosides. Antimicrobial Agents and Chemotherapy. 2000; 44: 665-675.
6.- Bankir L, Tinh-Trang-Tan MM. Urea and the kidney. Philadelphia. W. B. Saunders Company. 2000: 637-652.
7.- Kokko J. Overview of renal physiology. In Kokko J, Tannen R (eds). Fluids and electrolytes. Philadelphia. W.B Saunders Company. 1996: 855-856
8.- Kaplan A, Kohn O. Fractional excretion of urea as a guide to renal dysfunction. Am J Nephrol 1992; 12: 49-54
Comentario del Dr Omar Abboud. Consultant Nephrologist. Hamad Medical Corporation, Doha, Qatar.
Sobre todo, se trata de un artículo bien presentado. El mecanismo propuesto para explicar la urea normal en el curso de una creatinina elevada en el suero del paciente con fallo renal agudo es lógico, y razonablemente apoyado por la evidencia dada. Hay algunos comentarios, que deben ser tomados en consideración:
Dos mecanismos potenciales fueron propuestos para el fallo renal aguda: una infección y antibióticos nefrotóxicos. Se asumió que las drogas fueron la causa del fallo renal, ya que comenzaron después de la iniciación de la terapia y se resolvió después de la discontinuación de las drogas. Aunque convengo con esta asunción, la infección habría podido ser la causa: conducir a un fallo renal que se resolvió con el bloqueo de la infección por los antibióticos. La posibilidad de factores múltiples tampoco puede ser eliminada.
Los factores que producían baja urea fueron referidos mencionando que el paciente no tenía ninguna enfermedad del higado, dieta baja en proteínas o desnutrición, pero el factor que conducía a la creatinina desproporcionadamente alta en la relación la urea no fue atribuído a algo, por ejemplo, excesivo daño muscular producido por el absceso.
Comentario del Dr Jesús Garrido. Unidade de Nefrologia e Diálise. Hospital São Teotónio de Viseu. Viseu. Portugal
Musso et el al. describen un caso interesante, en el cual la nefrotoxicidad de la droga, especialmente amikacina, cursa con un fallo renal agudo con nivel de urea plasmática normal.
Los Aminoglucósidos son el prototipo de drogas que tienen como efecto secundario importante la nefrotoxicidad. El número de pacientes que desarrollan nefrotoxicidad aumenta con el duración de la terapia, y el 50% que alcanza con 14 días o más del tratamiento. Clásicamente, se presenta como necrosis tubular aguda, generalmente no-oliurica. Otras características incluyen: disfución tubular próximal, enzimuria, proteinuria, glucosuria, hipokalemia, hipomagnesemia... La recuperación es lenta y requiere de 4-6 semanas.
A pesar de su potencial nefrotóxico, los antibióticos aminoglucósides todavía son considerados agentes importantes contra infecciones que comprometen la vida. La meta de identificar y de reducir esta toxicidad ha promovido mucho esfuerzo durante los últimos años. Una observación atenta y cuidadosa de la función tubular proximal, para descubrir la lesión renal en estadío precoz podría evitar las peores consecuencias. Un marcador rápido de la disfunción tubular en esta patología es la actividad urinaria del N-acetilo-B-D-glucosaminidase (NAG), que aumenta en caso de daño tubular próximal. Se ha descrito varios agentes de mejora de la nefroxicidad, con más o menos eficacia, como: betabloqueantes, vitaminas, antioxidantes (un compuestos derivados ajo S-allylmercaptocisteína, trans-resveratrol...), drogas antiplaquetarias (trapidil), melatonina...
La nefrotoxicidad de estas drogas es frecuente pero este caso es inusual. El interés de este caso es la posibilidad de conseguir un marcador tubular más próximo del daño tubular para identificar cuanto antes la toxicidad renal.
Recibido: 18 de Junio de 2004.
Recibido revisado: 28 de Julio de 2004
Publicado: July 31, 2004
