Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
FRACASO RENAL AGUDO EN EL PACIENTE ONCOLOGICO. ANALISIS CLINICO Y PRONOSTICO.
Lavilla FJ, Martín S, García Fernandez N, Hernandez AP, Pujante D,
Martín P, Purroy C, Purroy A, Errasti P.
Servicio de Nefrología y *Departamento de Oncología
Clínica Universitaria de Navarra. Pamplona. España
Rev Electron Biomed / Electron J Biomed 2004;3:9-14.
Comentario del Revisor Dr. Jesús Garrido, MD. Unidade de Nefrologia e Diálise. Hospital São Teotónio de Viseu. Portugal
Comentario del Revisor Prof. Abdías Hurtado. Servicio de Nefrologia. Hospital Arzobispo Loayza. Universidad Peruana Cayetano Heredia. Lima. Peru
El fracaso renal agudo es un problema frecuente en el paciente oncológico, que plantea limitaciones en el pronóstico y en el planteamiento terapeútico. El desarrollo de registros de pacientes oncológicos con fracaso renal agudo permite analizar el perfil clínico y plantear aspectos a desarrollar desde el punto de vista terapeútico y sobre todo preventivo. El empleo de determinados índices pronósticos como el ISI (Liaño) o el de fallo multiorgánico permite evaluar mejor este perfil clínico. En nuestra experiencia el fracaso renal agudo en el paciente oncológico es una complicación frecuente y relacionada con el proceso de base. Mediante este registro de pacientes hemos identificado un perfil clínico de alto riesgo consistente en un paciente con un fallo renal asociado a un proceso infeccioso, con insuficiencia respiratoria, oligúrico y con una puntuación elevada de esos índices pronósticos.
INTRODUCCIÓN
El fracaso renal agudo (FRA) en los pacientes oncológicos tiene múltiples causas1. Las más habituales son las relacionadas con el tratamiento o con complicaciones derivadas del propio proceso neoplásico. En nuestro centro tenemos abierto un estudio prospectivo observacional sobre el FRA en el que incluimos todos los pacientes vistos por nuestro departamento.
MATERIAL Y MÉTODOS:
Esta base de datos se inició en Enero de 1996 y hasta Marzo del 2003 están incluidos 1005 pacientes, de los cuales 384 eran pacientes del departamento de Oncología (patología neoplásica diagnosticada y confirmada como proceso de base fundamental). Se definió como fracaso renal agudo una oscilación de los niveles de creatinina por encima del 20%, este criterio de inclusión aparece en la literatura2. Es un límite que puede parecer poco estricto pero en nuestro centro estamos considerando también los FRA leves por su frecuencia elevada sobre todo en los pacientes con nefropatía crónica.
Los pacientes incluidos en este estudio presentaban una edad media de 56 años (EE 0'7), siendo varones el 65'9%.
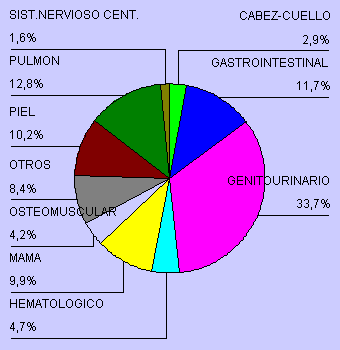
Figura 1.- Tipo de tumores
Se evaluó en estos pacientes la etiología, el comportamiento clínico, la gravedad y su pronóstico. La etiología se definió según fuera un fracaso prerenal o funcional, renal o parenquimatoso, o postrenal. Debido a que en muchos pacientes influían factores funcionales y parenquimatosos en la aparición del FRA, se definió otro grupo etiológico como fracaso mixto (prerenal y renal). Se determinó también la presencia de un proceso inflamatorio (temperatura >38ºC, con modificación de los niveles de leucocitos o reactantes de fase aguda -proteína C reactiva, albúmina-). El origen del cuadro inflamatorio se valoró como infeccioso si se aislaba un germen causante de dicho estado. En el comportamiento clínico se evaluó la presencia de oliguria (diuresis por debajo de 400 ml al día), hipotensión (tensión arterial sistólica por debajo de 100 mmHg durante más de 10 horas), la necesidad de respiración asistida, la existencia de ictericia (bilirrubina por encima de 2'5 mgr %), la presencia de coma o por el contrario un nivel de conciencia mantenido. Se determinó el tratamiento del FRA conservador (fluidoterapia, dopamina o diuréticos) o sustitutivo de la función renal (mediante técnicas intermitentes, contínuas o ambas). Se valoraron todos estos parámetros en relación con la mortalidad durante el episodio de fracaso renal. Además se determinaron dos índices pronósticos, el índice de severidad individual de Liaño (ISI)3,4,5 y un índice de fallo multiorgánico (IFMO). Por último, se valoró el motivo de ingreso del paciente oncológico, según fuera para recibir un determinado tratamiento (quimioterapia, inmunoterapia o radioterapia) o provocado por la aparición de alguna complicación en relación con el tratamiento o proceso tumoral.

Tabla 1: Índice de severidad individual o de Liaño.
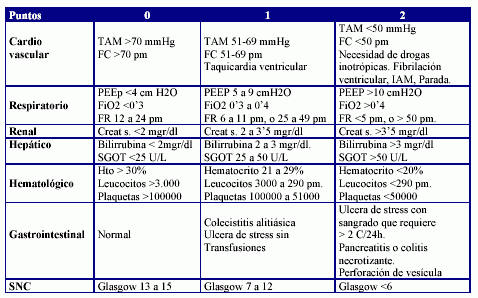
Tabla 2: Índice de Fallo multiorgánico o IFMO.
RESULTADOS
Análisis descriptivo:
La etiología del FRA fue prerenal en el 15'7% de los casos, renal en el 38'4%, mixto en el 37'6%, postrenal en el 4'2% y de otra naturaleza en otro 4'2 %. Se objetivó la presencia de un proceso inflamatorio en 168 pacientes, siendo de naturaleza infecciosa en el 38'1% de los casos. El foco infeccioso más frecuente fue el respiratorio con un 43'1%, seguido del abdominal con un 24'6%. Destaca el hecho de que el origen de la infección fue hematológico (relacionado con accesos vasculares) en un 9'2%.
El FRA fue oligúrico en el 26%, se asoció a hipotensión en el 25%, precisó respiración asistida en el 13'8%, se asoció con ictericia en el 15'9% y con presencia de coma en el 12'8%. Se observó la presencia de un fallo cardiovascular en el 23'4% de los pacientes, un fallo respiratorio en el 25% y un fallo hepático en el 18% de los casos. Fue especialmente frecuente la presencia de un fallo hematológico (60'4%).
Este FRA respondió al tratamiento conservador en el 79'2% de los pacientes, precisando un método de sustitución de la función renal en el resto, empleándose técnicas intermitentes en el 8'3%, contínuas en el 9'1% y ambas en el 3'4%. La mortalidad durante el fracaso renal agudo fue del 18'5%.
Análisis pronóstico:
La puntuación obtenida por el ISI fue en toda la población analizada, de 0'2359 (EE 0'0126). La distribución por frecuencias no fue normal, apreciándose además una morfología de curva bimodal con dos picos máximos de distribución por frecuencias.
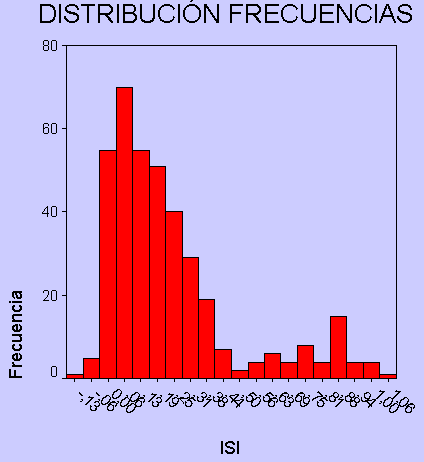
Figura 2.- Distribución por frecuencias del ISI
El área bajo la curva a la hora de predecir el riesgo de fallecimiento de este índice es aceptable, con un valor de 0'851 (p<0'001, IC 95% 0'792 a 0'911). Este riesgo de fallecimiento es más elevado con una puntuación por encima de 0'5. Obtener un índice por debajo de ese límite resulta protector respecto a ese riesgo, con una OR de 0'017 (p<0'001, IC 0'007 a 0'04). Además esa puntuación de 0'5 es el punto de inflexión que separa las dos poblaciones observadas en la distribución por frecuencias del ISI. Al analizar la influencia de las distintas variables incluidas en ese índice sobre el riesgo de fallecimiento, el estudio de regresión logística multivariante destaca la presencia de coma con una OR 63'308 (IC 95% 26'06 a 153'57). Descartando las variables neurológicas en el análisis de regresión logística, aparece como variable independiente que influye de forma significativa sobre un mayor riesgo de fallecer, la necesidad de respiración asistida con una OR de 22'87 (p<0'001, IC 95% 11'38 a 45'95).
Respecto al IFMO, la puntuación media obtenida en la población estudiada es de 3'05 (EE 0'1406). El área bajo la curva a la hora de predecir la mortalidad es también aceptable con un valor de 0'889 (p<0'001, IC 95% 0'846 a 0'932). La mortalidad es mayor con una puntuación cercana a 5.
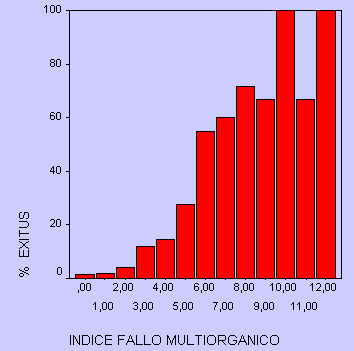
Figura 3.- Porcentaje de pacientes fallecidos, según puntuación IFMO
Entre los fallos orgánicos incluidos en la evaluación de este índice destaca la presencia de fallo agudo respiratorio con una OR de 6'146 (p<0'001, IC 95% 4'255 a 8'876).
Motivo de ingreso:
Los pacientes que presentaron un FRA durante el ingreso hospitalario secundario a la aparición de complicaciones por el tratamiento, presentaron un peor pronóstico. Este pronóstico se relacionó con un perfil de paciente en el que se refleja un FRA muy funcional, asociado a un estado inflamatorio sobre todo infeccioso, más oligúrico y que precisa con más frecuencia un tratamiento sustitutivo de la función renal, y con un peor comportamiento de los índices pronósticos.
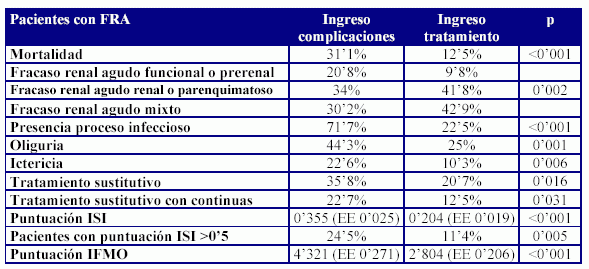
Tabla 3: Diferencias entre el FRA que aparece en los pacientes ingresados para tratamiento, del que aparece cuando el ingreso se debe a una complicación del mismo o del propio proceso tumoral.
DISCUSIÓN
El FRA en el paciente oncológico presenta un origen multifactorial con una incidencia de factores funcionales y parenquimatosos en un porcentaje apreciable de pacientes. Entre los factores funcionales analizados en este estudio se incluye la presencia de hipovolemia absoluta, relativa no inflamatoria (cambios hemodinámicos) o inflamatoria (con presencia de hipovolemia vascular asociada o no a cambios hemodinámicos). Se ha considerado también la presencia de hipoxemia tisular (saturación arterial de oxígeno menor del 95%), relacionada con un descenso en la oxigenación central o por una disminución en el transportador (anemia con un nivel de hemoglobina por debajo de 10 g/dL). Dentro de los factores parenquimatosos, tiene especial importancia en estos pacientes la administración de nefrotóxicos, fundamentalmente quimioterápicos.
Respecto a la presencia de un estado inflamatorio, la definición que se emplea en este estudio no se basa en los criterios establecidos de SIRS, debido a que su aplicación es compleja y limitada a las Unidades de Cuidados Intensivos. Se ha preferido emplear unos criterios clínicos y bioquímicos que permiten detectar ese estado en pacientes incluso hospitalizados fuera de esas Unidades. Ese estado inflamatorio supone una serie de alteraciones importantes en el medio interno. La inflamación determina el consumo de albúmina con la consiguiente caída en la presión oncótica intravascular, que junto al aumento de la permeabilidad capilar favorece la salida de agua hacia el espacio intersticial. Esa salida de líquido al espacio intersticial favorece la aparición de un edema que en tejidos periféricos no supone un gran problema, pero que a nivel pulmonar puede precipitar un descenso en la capacidad de transferencia de oxígeno agravando una posible hipoxia tisular.
A nivel renal, un estado inflamatorio provoca cambios debido a las posibles consecuencias hemodinámicas, y además favorece la redistribución de flujo hacia córtex empeorando una isquemia medular, antesala de una lesión más parenquimatosa o necrosis tubular aguda6,7,8,9. Por eso, la presencia de un estado inflamatorio determina la existencia de un FRA funcional pero asociado a una afectación parenquimatosa siendo difícil determinar esa fase de tránsito salvo por el comportamiento de los electrolitos en orina (natriuresis) o la evolución y respuesta de la función renal a las distintas maniobras terapeúticas introducidas (reposición de volemia intravascular, soporte inotrópico). En los pacientes oncológicos puede haber cierta actividad inflamatoria paratumoral o secundaria al tratamiento (como sucede en los tratados con inmunoterapia)10, pero en muchos casos se debe a la incidencia de alguna complicación, sobre todo infecciosa.
En este estudio se aprecia un porcentaje considerable de pacientes con un estado inflamatorio, en muchos casos debido a un proceso infeccioso destacando aquellos con un foco respiratorio como origen (neumonías, bronconeumonías). Además destaca el porcentaje de pacientes con un proceso infeccioso de origen hematológico (muy relacionado con las bacteriemias por accesos venosos). El tratamiento en la mayor parte de los casos ha sido conservador, basado en una optimización del medio interno (hemoglobina, oxigenoterapia, reposición de la volemia vascular) y en el tratamiento con diuréticos.
Aunque se menciona al principio del trabajo el empleo de dopamina, prácticamente se ha llegado a utilizar en muy pocos casos al ser una droga en revisión respecto a su eficacia sobre todo en disminuir la mortalidad del FRA o el requerimiento de diálisis. El tratamiento sustitutivo de la función renal no se limita al uso de técnicas intermitentes sino que en esta población el empleo de técnicas contínuas es frecuente es sus diferentes modalidades (ultrafiltración aislada, hemodialisis, hemofiltración o hemodiafiltración venovenosa continua).
El FRA en el paciente oncológico presenta según este estudio un pronóstico relacionado con el proceso de base. La mortalidad aún no siendo excesiva, es importante. Esa mortalidad es mayor en aquellos pacientes con un deterioro respiratorio agudo asociado o no a un proceso infeccioso. Existe cierta dificultad para evaluar la presencia de un deterioro neurológico salvo cuando es grave o se trata de un estado de coma. Por eso aunque es cierto que la existencia de ese coma supone un riesgo elevado de fallecimiento al tratarse habitualmente de un proceso irreversible que en los pacientes oncológicos se relaciona con la presencia de enfermedad a ese nivel, se eliminó del modelo estadístico para poder evaluar otras variables clínicas. En ese caso, ambos índices pronósticos revelan la importancia de ese fallo respiratorio en el pronóstico del FRA. Ese fallo respiratorio puede ser infeccioso pero en la población oncológica tiene otras implicaciones al producirse también en relación con el manejo incorrecto de los balances hídricos sobre todo cuando existe ya un fallo renal, y por el deterioro físico que presentan esos pacientes. Ese deterioro físico está relacionado con la pérdida de masa muscular, la desnutrición y el encamamiento que reduce considerablemente la capacidad de volumen inspiratorio y favorece la aparición de atelectasias.
Respecto a la oliguria, en esta casuística la íncidencia es baja posiblemente a que en muchos casos el FRA es leve o moderado, y que a pesar del empleo de ciertos nefrotóxicos o a la presencia de un componente funcional (hipovolemia absoluta o relativa), la diuresis no llega a perderse completamente (anuria), debido a que la presencia de otras variables que constituyen un fallo multiorgánico como la hipotensión o el fracaso respiratorio tampoco es importante. Ahora bien, mantiene su influencia sobre el pronóstico pero sólo en el análisis univariante como ocurre con las demás variables incluidas en el ISI a excepción del coma o la necesidad de respiración asistida (resultados no mostrados).
No se puede considerar por igual cualquier paciente oncológico. La búsqueda de subpoblaciones de riesgo resulta útil a la hora de manejarlos adecuadamente. Los pacientes que presentan FRA relacionado con una complicación derivada del tratamiento o de la progresión de la enfermedad, tienen un perfil clínico de peor comportamiento. Es un fracaso en gran parte funcional, pero asociado a procesos infecciosos, con pérdida de la diuresis y con peor puntuación de los índices pronósticos lo cual implica con mayor frecuencia la presencia de un fallo multiorgánico, y una peor respuesta al tratamiento conservador.
CONCLUSIONES
El FRA en el paciente oncológico es un proceso que relacionado con la enfermedad de base, presenta un comportamiento dependiente de la evolución del cuadro responsable de esa situación.
La identificación de un perfil clínico de alto riesgo, facilita la detección de pacientes críticos susceptibles de un control más exhaustivo así como de un tratamiento más agresivo de su proceso de base. Concretamente, el paciente con un fracaso renal asociado a un proceso infeccioso, con fallo respiratorio, oligúrico y con una puntuación elevada de los índices pronósticos debería ser manejado según las premisas comentadas anteriormente.
BIBLIOGRAFIA.
1- Weinman EJ, Patak RV. Acute renal failure in cancer patients. Oncology (Huntingt). 1992 Sep;6(9):47-52; discussion 52-4.
2- Macias-Nunez JF, Fernandez R, Calvo C, Grande J, Herrera J, Bustamante J, Garay R, Robles R, Lopez-Novoa JM. Verapamil reverts acute renal functional impairment induced by angiotensin II converting enzyme inhibitors. Ren Fail. 2003 Sep;25(5):727-37.
3.-Liano F, Junco E, Pascual J, Madero R, Verde E. The spectrum of acute renal failure in the intensive care unit compared with that seen in other settings. The Madrid Acute Renal Failure Study Group.Kidney Int Suppl. 1998 May; 66: S16-24.
4.-Liano F, Pascual J. Epidemiology of acute renal failure: a prospective, multicenter, community-based study. Madrid Acute Renal Failure Study Group. Kidney Int. 1996 Sep; 50(3): 811-8.
5.-Liano G, Pascual J. Acute renal failure. Madrid Acute Renal Failure Study Group.Lancet. 1996 Feb 17; 347(8999): 479;
6.-Conesa EL, Valero F, Nadal JC, Fenoy FJ, Lopez B, Arregui B, Salom MG. N-acetyl-L-cysteine improves renal medullary hypoperfusion in acute renal failure. Am J Physiol Regul Integr Comp Physiol. 2001 Sep;281(3):R730-7.
7.-Rosen S, Epstein FH, Brezis M. Determinants of intrarenal oxygenation: factors in acute renal failure.Ren Fail. 1992; 14(3): 321-5.
8.-Brezis M, Heyman SN, Dinour D, Epstein FH, Rosen S. Role of nitric oxide in renal medullary oxygenation. Studies in isolated and intact rat kidneys. J Clin Invest. 1991 Aug;88(2):390-5.
9.-Paller MS, Manivel JC. Prostaglandins protect kidneys against ischemic and toxic injury by a cellular effect. Kidney Int. 1992 Dec;42(6):1345-54.
10.-Ponce P, Cruz J, Travassos J, Moreira P, Oliveira J, Melo-Gomes E, Gouveia J. Renal toxicity mediated by continuous infusion of recombinant interleukin-2.Nephron. 1993;64(1):114-8.
Comentario del Revisor Dr. Jesús Garrido, MD . Unidade de Nefrologia e Diálise. Hospital São Teotónio de Viseu. Portugal
La mortalidad de la insuficiencia renal aguda (IRA) ha permanecido elevada desde el inicio de la hemodiálisis hace 30-40 años a pesar de los avances en los tratamientos de soporte, sin duda facilitada por la variación "demográfica" de esta patología (población cada vez mas envejecida y una comorbilidad asociada creciente). La mortalidad de la insuficiencia renal aguda sin otras patologías acompañantes está entre el 7-23%1 mientras que alcanza el 50-80% en las Unidades de Cuidados Intensivos2,3,4. Los pacientes que requieren tratamiento substitutivo presentan una mortalidad del 50-70%. Las infecciones así como las complicaciones cardiopulmonares son las principales causas de muerte5. Un hecho interesante en los últimos años ha sido el desarrollo de índices de predicción de la gravedad o mortalidad asociados a la IRA. Además de los tratamientos sustitutivos de soporte (HD, HDF, HFVVC...) son varias las líneas terapéuticas en investigación dentro del tratamiento del fracaso renal agudo6,7. El pronóstico de la IRA está determinado por la gravedad de la enfermedad de base y por el número de órganos disfuncionantes asociados. Los pacientes oncológicos, son un grupo especial de riesgo para el desarrollo de IRA ya que, además de la propia quimioterapia muchas veces nefrotóxica, el proceso de base y sus complicaciones aumentan significativamente la morbi-mortalidad.
El presente trabajo al analizar su experiencia en este grupo especial de población incide en la importancia de identificar grupos especiales de riesgo lo que podrá ayudar a un mejor conocimiento y manejo del fracaso renal agudo en el paciente oncológico.
Referencias:
1. Thadhani R, Pascual M, Bonventre JV: Medical progress- Acute renal failure. N Engl J Med. 1996; 334:1448-1460. Review.
2. Chertow GM, Christiansen CL, Cleary PD, Munro C, Lazarus JM: Prognostic stratification in critically ill patients with acute renal failure requiring dialysis. Arch Inter Med 1995; 155:1505-1511.
3. Paganini EP, Tapolyai M, Goormastic M, Halstenberg W, Kozlowski L,Leblanc M, Lee JC, Moreno L, Sakai K: Establishing a dialysis therapy patient outcome link in intensive care unit acute dialysis for patients with acute renal failure. Am J Kidney Dis 1996; 28 (Suppl 3):S81-S89.
4. Liaño F, Junco E, Pascual J, Madero R, Verde E, Madrid Acute Renal Failure Study Group. Referencia en el trabajo.
5. Robert W, Wang W, Poole B, Mitra A. Acute renal failure: definitions, diagnosis, pathogenesis and therapy. J Clin Invest 2004 Jul 1;114(1):5-14.
6. Vanholder R, Lamiere N. Acute renal failure: future directions for research. Nephrology 2001; 6:57-61. Review.
7. Robert A Star. Treatment of acute renal failure. Kidney Int 1998; 54:1817-1831.
Comentario del Revisor Prof. Abdías Hurtado.Servicio de Nefrologia. Hospital Arzobispo Loayza. Universidad Peruana Cayetano Heredia. Lima. Peru
El trabajo de Lavilla y colaboradores, nos presenta el “fracaso renal agudo (FRA) en el paciente oncológico”, un tema con escasos reportes en la literatura.
Los autores utilizan como definición de FRA el incremento de los niveles de creatinina por encima del 20%. Existe consenso en la definición general de FRA como: la pérdida brusca de la función renal suficiente como para disminuir la eliminación urinaria de productos nitrogenados1. En lo que no hay acuerdo es en la magnitud del incremento de la creatinina para definir el diagnostico, los criterios mas usados son: Incremento de creatinina en sangre de 0.5 mg/dl sobre el basal; incremento del 50% sobre la línea de base2, 3.
El haber utilizado como criterio de FRA un incremento del 20%, ha influido en los resultados presentados: a) Elevación de la incidencia del FRA. b) Un elevado numero de pacientes recuperaron con tratamiento conservador (79.2%). c) Baja mortalidad (18,5%), considerando que para ese grupo etareo la mortalidad reportada varia entre el 50 al 60%4.
Es interesante el mensaje de enfocar la FRA como un fenómeno inflamatorio, en el que hay interacción entre el endotelio dañado, células inflamatorias y el epitelio tubular, a través de la generación de citoquinas y chemoquinas.
Referencias:
1.- Nolan C, Anderson R. Hospital-acquired acute renal failure. J Am Soc Nephrol. 1998; 9:710-8.
2.- Thadhani R, Pascual M, Bonventre JV. Acute renal failure. N Engl J Med. 1996; 334:1448-60.
3.- Bellomo R, Kellum JA, Ronco C. Defining acute renal failure: physiological principles. Intensive Care Med. 2004; 30:33-7
4.- Fernando Liaño. Acute Renal Failure, Atlas of Kidney Disease, Ed. Robert W. Schrier http://www.kidneyatlas.org
Recibido: 20 de agosto de 2004. Recibido revisado 1 de Noviembre de 2004.
Publicado: 6 de Noviembre de 2004
