Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
LA DENSIDAD ÓPTICA APLICADA AL ESTUDIO LECTINHISTOQUÍMICO DE RADICALES GLUCÍDICOS NÉFRICOS EN RATAS DIABÉTICAS TIPO 2
Ana V Frontini1, Noriyuki Hisano1, Alberto E D'Ottavio1,2
Facultad de Ciencias Médicas1, y Consejo de Investigaciones2,
Universidad Nacional de Rosario. Rosario. Argentina
aedottavio @ hotmail.com
Rev Electron Biomed / Electron J Biomed 2008;1:36-42
Comentario del revisor Jesús Garrido, MD. Unidade de Nefrologia e Diálise. Hospital São Teotónio de Viseu. Viseu. Portugal.
Comentario del revisor Marta Herreros Villanueva PhD. Fundación Burgos por la Investigación de la Salud. Unidad de Investigación del Hospital General Yagüe. Burgos. España
RESUMEN
Este trabajo analiza, mediante densidad óptica (DO), residuos glucídicos en glomérulos y túbulos contorneados proximales, superficiales y yuxtamedulares, de dos líneas de ratas diabéticas: eSS y eSMT al año de edad. 10 ratas macho eSS, 12, eSMT y 10, Wistar (controles) fueron estudiadas con distintas lectinas (PNA, RCA, Con-A, DBA, SBA, WGA y UEA-I). La densidad óptica (DO) fue determinada mediante el Programa Image-pro Plus versión 1.1, estableciéndose rangos para la evaluación de la reacción cromogénica (> 200 = 0 (negativa); entre 150 y 200 = 1-2 (débil o moderada positividad), y < 150 = 3 (fuerte positividad). Los principales resultados diferenciales fueron registrados: (a) en los glomérulos superficiales: WGA: eSMT (DO=3) versus eSS y Wistar (DO = 1-2), y UEA-I y Con-A: Wistar (DO= 3) versus líneas diabéticas (DO =1-2); (b) en los glomérulos yuxtamedulares: WGA: Wistar y eSMT (DO = 3) versus eSS (DO= 1-2), UEA-I: líneas diabéticas (DO= 3) versus Wistar (DO=1-2), y Con-A: Wistar (DO =3) versus líneas diabéticas (DO = 1-2), y (c) en las células de los túbulos proximales yuxtamedulares: WGA y Con-A: líneas diabéticas (DO=1-2) versus Wistar (DO= 3), y UEA-I: eSS (DO=3) versus eSMT y Wistar (DO=1-2). Las diferencias entre ratas diabéticas y controles podrían atribuirse a su dismetabolismo, y las de las líneas diabéticas entre sí, a sus distintos orígenes. Asimismo, podrían señalar alteraciones en la filtración y en procesos tubulares intracelulares, coincidiendo con trabajos previos acerca de una nefropatía en evolución a esta edad en eSS y eSMT.
PALABRAS CLAVE:Densidad óptica. Lectinas. Glúcidos. Riñón. Ratas. Diabetes.
SUMMARY
This paper analyzes glucidic residues through optical density (OD) in superficial and juxtamedullary glomeruli and convoluted proximal tubules of two one-year-old diabetic lines of rats: eSS and eSMT. 10 eSS, 12 eSMT and 10 Wistar male rats (controls) were studied with different lectins (PNA, RCA, Con-A, DBA, SBA, WGA and UEA-I). The OD was determined using the Image-pro Plus Software 1.1. Ranges were established for evaluating the chromogenic reaction (> 200 = 0 (negative); between 150 and 200 = 1-2 (weakly or moderately positive), and < 150 = 3 (strongly positive). Main differential results were registered. (a) in superficial glomeruli: WGA: eSMT (OD=3) versus eSS and Wistar (OD = 1-2), and UEA-I and Con-A: Wistar (OD = 3) versus diabetic lines (OD =1-2); (b) in juxtamedullary glomeruli: WGA: Wistar and eSMT (OD = 3) versus eSS (OD = 1-2), UEA-I: diabetic lines (OD = 3) versus Wistar (OD =1-2), and Con-A: Wistar (OD =3) versus diabetic lines (OD = 1-2), and (c) in juxtamedullary proximal tubules cells: WGA and Con-A: diabetic lines (OD =1-2) versus Wistar (OD = 3), and UEA-I: eSS (OD =3) versus eSMT and Wistar (OD =1-2). Differences between diabetic lines and controls may be attributed to its dysmetabolism whilst those between diabetic lines, to its distinct origins. Likewise, alterations in filtration and in intracellular tubular processes could be put into evidence in congruence with previous reports about a diabetic nephropathy in eSS and eSMT at this age.
KEY WORDS:Optical Density. Lectins. Carbohydrates. Kidney. Rats. Diabetes
INTRODUCCION
La diabetes tipo 2 se caracteriza por anomalías metabólicas y complicaciones a largo plazo, resultantes de tales anomalías en general y de la hiperglucemia en particular, que afectan esencialmente a ojos, sistema nervioso, piel, vasos sanguíneos y riñones. En estos últimos, suele provocar un conjunto de lesiones reunidas bajo la denominación de nefropatía diabética y que incluye primordialmente a la glomerulopatía, la hialinización de las arteriolas aferente y eferente, lesiones tubulares así como susceptibilidad al desarrollo de pielonefritis y de necrosis papilar1.
La diabetes es causa relevante de insuficiencia renal crónica, cuya expresión primera suele ser la proteinuria persistente. Si bien en las fases iniciales de la afección renal el control metabólico es un condicionante de la evolución de la enfermedad, su trascendencia es menor en los estadios más avanzados2-7.
Para el estudio de la diabetes y sus complicaciones, la OMS postula el uso de modelos animales. En tal sentido, la Facultad de Ciencias Médicas dispone en la Cátedra de Biología de dos líneas de ratas diabéticas tipo 2; una, espontánea (eSS) y otra, sintética (eSMT). La línea eSS, no obesa, revela un síndrome diabético temprano, más severo en machos, caracterizado por intolerancia a la glucosa, hiperglucemia y glucosuria así como por cambios morfológicos diacrónicos compatibles con nefropatía diabética. A su vez, la línea eSMT, obtenida mediante el cruce de ratas eSS con ratas ß - genéticamente obesas y diabéticas tipo 2 tardías - presentan al año de edad un síndrome diabético más severo que el de su línea parenteral eSS, de mayor gravedad en machos, y desarrollan, como eSS, una nefropatía diabética con el paso de la edad8-9.
La nefropatía diabética, con sus alteraciones concomitantes en los mecanismos de glucosilación, puede ser indagada de variadas maneras. Una de ellas, denominada lectínhistoquímica, se basa en el empleo de lectinas, grupo heterogéneo de proteínas o de hidratos de carbono unidos a proteínas, de origen no inmune y con capacidad para localizar, reconocer y unirse específica, sensible y reversiblemente a carbohidratos simples y a glucoconjugados, en tejidos normales y patológicos10-11.
Para brindar mayor objetividad, validez y fiabilidad a los datos histoquímicos resultantes del uso de lectinas se recurrió al análisis de la densidad óptica (DO)12, procedimiento analítico de imágenes que provee información acerca de la cantidad de lectinas fijadas a componentes glúcidos, mediante la intensidad de luz transmitida que logra atravesarlos; vale decir, la lectina se fija específicamente a un grupo glúcido y la DO mide la cantidad de ella adherida al mismo.
En tal contexto, el presente trabajo estudia, mediante la DO, radicales glucídicos localizados en determinados segmentos del nefrón de dos líneas autóctonas de ratas diabéticas eSS (espontánea) y eSMT (sintética) al año de edad e intenta aportar conductas prácticas derivadas de dicho estudio.
MATERIAL Y MÉTODO
22 ratas diabéticas macho (10, eSS y 12, eSMT) y 10 ratas macho Wistar, empleadas como controles, fueron sacrificadas al año de edad con sobredosis de éter bajo campana de vidrio, previa pesada de las mismas y respetando las normas éticas que rigen para esta clase experiencias. Se accedió a la celda renal mediante una incisión mediana longitudinal del abdomen y apartamiento de los intestinos. Tras disecar la grasa perirrenal, los riñones fueron pesados, seccionados y fijados en líquido de Bouin (45 minutos) y Formol al 10% en PBS (Buffer salino de Fosfato 0,01 M) (3 horas). Dichos órganos se procesaron con la técnica habitual de inclusión en parafina, realizándose cortes de 6 µm de espesor, para su posterior desparafinación y rehidratación. La peroxidasa endógena se inactivó con una solución de H2O2 (100V) al 3% en metanol. Luego, los especímenes fueron lavados con PBS, secados y tratados con una solución de Albúmina Sérica Bovina. Seguidamente, fueron expuestos a las siguientes lectinas: Arachis hypogaea (PNA), Ricinus communis (RCA), Canavalis ensiformis (Concanavalina A/ Con-A), Dolichos biflorus (DBA), Glycine max (SBA), Triticum vulgaris (WGA) y Urex europeus (UEA-I) e incubados a 4º C durante toda la noche. Al día siguiente, se lavaron con PBS, se cubrieron con el complejo CAB (Complejo Avidina-Biotina), fueron nuevamente lavados con PBS, sometidos a la DAB (Diaminobencidina), lavados con agua destilada y coloreados con hematoxilina a modo de contraste. Finalmente, fueron deshidratados, montados y colocados en un microscopio óptico de investigación Zeiss dotado de una videocámara digital color modelo Sony Exwavehad.
Las fotos digitales obtenidas en color real fueron seleccionadas y transformadas en una imagen en escala de grises para, luego, determinar las densidades ópticas en corpúsculos y túbulos contorneados proximales (TCP), superficiales y yuxtamedulares, mediante el Programa Image-pro Plus versión 1.1 (Media Cybernetics)13-16.
Para establecer la escala más abajo detallada se midieron las estructuras renales citadas a 400 aumentos a razón de 8 contajes/estructura/animal El programa proveyó automáticamente el promedio ± desvío estándar de fijación de lectina para cada contaje, procediéndose finalmente a establecer el promedio final de fijación lectínica en la totalidad de contajes efectuados en cada estructura de cada línea de ratas. El cero se seleccionó a partir de una zona no reactiva a las lectinas y su valor máximo, cercano a 250, se obtuvo de la zona de mayor reactividad lectínica (figura 1).
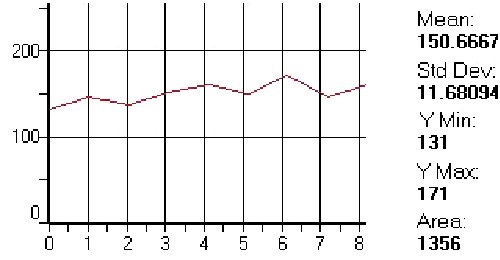
Gráfica obtenida con promedio, desvío estándar y medidas máxima y mínima (rango)
obtenidas tras 8 mediciones con Arachis hypogaea (PNA) en células de un
túbulo contorneado proximal de rata eSS macho de un año de edad.
La evaluación microscópica, visual y cualitativa, fue (++)
Partiendo de los promedios obtenidos, la DO de las lectinas se graduó según la escala semicuantitativa que sigue: DO = 200 = negativa - 0 -, DO entre 150 y 200 = débil a moderadamente positiva - 1 a 2- y DO = 150 = fuertemente positiva - 3 -.
RESULTADOS
El epitelio parietal de la cápsula de Bowman en los corpúsculos superficiales y yuxtamedulares resultó reactivo a todas las lectinas en todas las ratas salvo para UEA-1: Wistar (DO=1-2) versus ambas líneas de ratas diabéticas (DO=0).
Los glomérulos superficiales y yuxtamedulares fueron DO = 1-2 para las lectinas en la totalidad de las líneas murinas analizadas con excepción de las que se enumeran:
1. Glomérulos superficiales: WGA: ratas eSMT (DO=3) versus ratas eSS y Wistar (DO = 1-2), y UEA-I y Con-A: ratas Wistar (DO= 3) versus ambas líneas diabéticas (DO =1-2)
2. Glomérulos yuxtamedulares: WGA: ratas Wistar y eSMT (DO = 3) versus ratas eSS (DO= 1-2), UEA-I: ambas líneas diabéticas (DO= 3) versus ratas Wistar (DO=1-2), y Con-A: ratas Wistar (DO =3) versus ambas líneas diabéticas (DO = 1-2)
A su vez, las células de los
1. TCP superficiales: evidenciaron DO= 1-2 en todas las ratas estudiadas para cualquier lectina de las empleadas
2. TCP yuxtamedulares: tuvieron DO=1-2 en las ratas analizadas para las lectinas utilizadas salvo en WGA y Con-A: ambas líneas diabéticas (DO=1-2) versus ratas Wistar (DO= 3), y en UEA-I: ratas eSS (DO=3) versus ratas eSMT y Wistar (DO=1-2).
Los ribetes en cepillo de los TCP superficiales y yuxtamedulares mostraron DO = 3 en todas las ratas y para todas las lectinas.
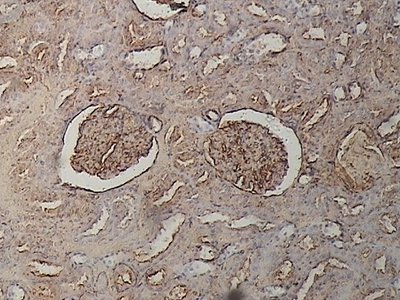
Ejemplo lectinhistoquímico cualitativo cuya densidad óptica fue igual a 3.
Se observan dos corpúsculos yuxtamedulares vecinos e hiperreactivos a la lectina WGA en el centro del campo microscópico.
Rata Wistar (control). 400 aumentos.
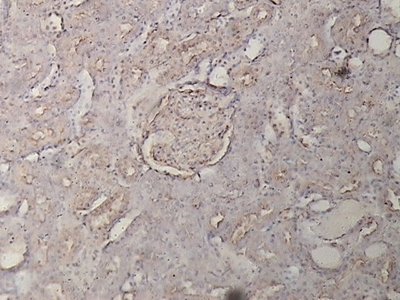
Ejemplo lectinhistoquímico cualitativo cuya densidad óptica fue igual a 1-2.
Se observa un corpúsculo yuxtamedular débilmente reactivo a la lectina WGA en el centro del campo microscópico.
Rata diabética eSS. 400 aumentos.
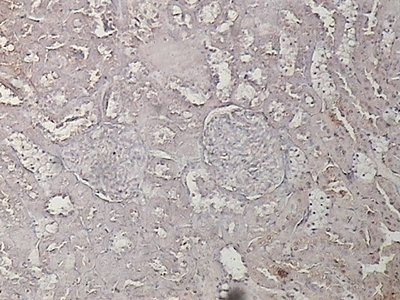
Ejemplo lectinhistoquímico cualitativo cuya densidad óptica fue igual a 0.
Se observan dos corpúsculos yuxtamedulares vecinos y no reactivos a la lectina UEA-I en el centro del campo microscópico.
Rata diabética eSMT diabética. 400 aumentos.
DISCUSIÓN
Los resultados fueron interpretados de acuerdo con los grupos glucídicos con los que reacciona cada lectina empleada. En ese sentido, corresponde señalar que PNA y RCA se unen primordialmente con N-acetil-alfa-D-galactosamina, RCA, además, presenta afinidad por oligosacáridos con ácido N-acetilneuramínico ó Neu5Ac en posición alfa 2-6, Con-A reacciona fundamentalmente con alfa-D-manosa y alfa- D- glucosa, DBA marca residuos de alfa -N- acetil D-galactosamina, SBA lo hace con N-acetil glucosamina y N-acetilgalactosamina, WGA con alfa- N-acetil- D-glucosamina y el ácido N-acetilneuramínico, y UEA - I, con alfa- L-fucosa y D-Galactosa17.
Las diferencias detectadas entre ambas líneas diabéticas y las ratas controles pueden atribuirse a su dismetabolismo mientras que las observadas entre ambas líneas diabéticas entre sí podrían deberse a su origen, señalado en la Introducción.
La presencia diferencial de determinadas lectinas en los glomérulos superficiales y profundos podría estar señalando su posible participación en la barrera hemo-renal durante el proceso de filtración. De modo similar, los resultados en las células de los TCP primordialmente yuxtamedulares parecerían más relacionados con procesos intracelulares que en las zonas reabsortivas de sus ribetes en cepillo con DO = 3 en todas las líneas de ratas y para la totalidad de lectinas analizadas.
Nuestros resultados coinciden parcialmente con los obtenidos por otros autores que detectaron alteraciones en residuos glucídicos de estructuras semejantes. Sin embargo, cabe destacar que estos estudios no emplearon densidad óptica y fueron realizados en otras líneas murinas diabéticas, diabetizadas con estreptozotocina y, también, en pacientes4-5, 8-10, 18.
Resumiendo, los datos señalarían modificaciones en residuos glucídicos de corpúsculos y túbulos contorneados proximales en estos dos modelos murinos autóctonos de diabetes tipo 2, ampliando con ello trabajos publicados previos en los que, valiéndonos de otras técnicas, fue demostrada a esta edad una nefropatía diabética en perceptible evolución19-21.
Si bien estos resultados en ratas no son directamente extrapolables al ser humano, podrían resultar de utilidad indicativa y comparativa en clínica nefrológica.
REFERENCIAS
1. Kumar V, Abbas AK, Fausto N: Robbins-Cotran Patología Estructural y Funcional, 7ª edición, Netherlands. 2005;
2. Farreras PV, Rozman C: Tratado de Medicina Interna (2 Tomos), 15ª edición, Editorial. Elsevier. 2006:
3. Rodés JT: Medicina Interna (2 Tomos). 2ª edición. Editorial Masson. 2004;
4. Móise B: Immunocytochemical detection of advanced glycated end products in rat renal tissue as a function of age and diabetes. Kidney International. 1998; 54: 438-447
5. Cohen JJ, Harrington JY & Madias NE: Protein glycation in the kidney: role in diabetes and aging. Kidney International .1996; 49: 1795-1804
6. Osterby R & Gundersen HJG: Fast accumulation of basement membrane material and the rate of morphological changes in acute experimental diabetic glomerular hypertrophy. Diabetologia.1980; 18: 493-500
7. Nanlpleri M., Lanfranchi A, Santerini D. et al: Influence of long - term diabetes on renal glycogen metabolism in the rat. Nephron,2001; 87: 50-57
8. Tomohiko K, Zenju T et al. Histochemical analysis of changes in lectin binding in murine glomerular lesions. The Japanese Society of Pathology.1989; 39: 31-41
9. Murata F, Tsuyama S et al. Distribution of glycoconjugates in the kidney studied by used of labeled lectins. The Journal of Histochemistry and Citochemistry. 1983; 31:139-144
10. Aguirre, JI, Han JS, Itagaki S & Doi K; Lectin histochemical study on the kidney of normal and streptozotocin-induced diabetic hamsters. Histol. Histopath.1993; 8: 273-278
11. Sassy-Prigent C, Heudes D et al.: Morphometric detection of incipient glomerular lesions in diabetic nephropathy in rats. Laboratory Investigation.1995; 73: 64-71
12. Davies A: Focal Digital Imaging A to Z. 2nd Edition. Netherlands. Elsevier B.V, 2005; 182
13. Kern T & Engerman, RL: Pharmacological Inhibition of Diabetic Retinopathy Aminoguanidine and Aspirin. Diabetes. 2001; 50:1636-1642
14. Wehbi GJ, Zimpelmann J, Carey RM y col.: Early streptozotocin-diabetes mellitus downregulates rat kidney AT2 receptors. 2001: Am J Physiol Renal Physiol 280: 254-265
15. Won Hong S, Isono M, Chen S y col.: Increased Glomerular and Tubular Expression of Transforming Growth Factor-ß1, Its Type II Receptor, and Activation of the Smad Signaling Pathway in the db/db Mouse. American Journal of Pathology. 2001; 158:1653-1663
16. Féliers D, Meredith AF & Riley D: Activation of Cyclin D1-Cdk4 and Cdk4-Directed Phosphorylation of RB Protein in Diabetic Mesangial Hypertrophy. Diabetes. 2002: 51:3290-3299
17. Sgambati E, Marini M, Vichi D, Zappoli Thyrion GD, Parretti E, Mello G, Gheri G: Distribution of the glycoconjugate oligosaccharides in the human placenta from pregnancies complicated by altered glycemia: lectin histochemistry Histochem Cell Biol. 2007; 128 :263-273
18. Tomino Y, Inoue W, Watanabe S, Yagame M, Eguchi K, Nomoto Y, Sakai H. Detection of glomerular sialic acids in patients with diabetic nephropathy. 1998; Am J Nephrol 8:21-26
19. Daniele SM, Arriaga S, D´Ottavio AE. et al.: Onset and evolution of nephropathy in rats with spontaneous diabetes mellitus. J. Physiol. Biochem. 2000; 56: 45-54
20. Tarrés MC, Montenegro SM, Martínez SM, Picena JC, Toniolo M, Figueroa NS, Naves A: The eSMT rat: a murine model of type 2 human diabetes. Animal research and welfare. A partnership proceedings of the international joint meeting XII ICLAS General Assembly & Conference 7th FELASA Symposium. J.A. Tur & JM. Orellana (Managing editors). Laboratory Animals Ltd, pp. 93-94, London, 2000
21. Picena JC, Daniele SM, Tarrés MC, Montenegro SM, Martínez SM, D'Ottavio AE: An animal model fits for studying divergences among diabetic microvascular complications. Electron J Biomed 2005;2:39-43.
Disponible en: http://biomed.uninet.edu/2005/n2/picena.html [citado 25 febrero 2008]
Agradecimiento: Los autores agradecen profundamente a la Cátedra de Biología (Medicina, Universidad Nacional de Rosario) la provisión de las ratas eSS y eSMT, en ella desarrolladas y criadas, así como al Prof. Dr. Rodolfo Tomás Puche la facilitación del Programa Image-pro Plus versión 1.1.
Correspondencia: Alberto E D'Ottavio - Matheu 371 - 2000 Rosario (Santa Fe). ARGENTINA
aedottavio @ hotmail.com
