Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
- Los profesionales sanitarios en Atención Primaria de Salud (APS), ante un paciente en el que observa un conjunto de signos, síntomas o alteración de algún examen de laboratorio, que hace sospechar una posible asociación con la utilización previa de un medicamento, deben iniciar el proceso de notificación. Pueden comunicarlo mediante el modelo 33-36-1 al jefe de grupo básico de trabajo o al director técnico de la farmacia comunitaria o al director de la farmacia principal municipal, que se lo entregarán al Farmacoepidemiólogo (Presidente del comité farmacoterapéutico municipal).
- Los profesionales sanitarios en los hospitales, ante un paciente, tanto ingresado como de cuerpo de guardia, en el que observa un conjunto de signos, síntomas o alteración de algún examen de laboratorio, que hace sospechar una posible asociación con la utilización previa de un medicamento, deben iniciar el proceso de notificación. Pueden comunicarlo mediante el modelo 33-36-1 al farmacoepidemiólogo del hospital o al director técnico-administrativo de la farmacia del hospital, estos se encargaran de velar por la calidad del llenado del modelo y de discutir las notificaciones en el seno del comité farmacoterapéutico
- La notificación de las sospechas RAM de frecuencia habitual de aparición se recibirán quincenalmente en la Unidad Coordinadora Nacional de Farmacovigilancia (UCNFv) mediante una base de datos en soporte magnético enviado por las Unidades provinciales, la cual será objeto de revisión por parte de los especialistas de la UCNFv.
- Una vez revisada cada sospecha de RAM, si cumple con los parámetros establecidos en la misma pasará a engrosar la base de datos nacional
- La notificación de todas las sospechas de RAM graves y mortales se notificarán vía telefónica y/o correo electrónico por la UCNFv, inmediatamente después de haber ocurrido la misma (siempre antes de las 24 horas), enviando posteriormente, y antes de los 10 días posteriores, la planilla electrónica (modelo 33-36-1) y la discusión del grupo de expertos provincial.
COMPORTAMIENTO DE LAS
REACCIONES ADVERSAS A MEDICAMENTOS
EN CUBA. AÑO 2007
Ismary Alfonso Orta MD, Giset Jiménez López MD,
Jenny Ávila Pérez, Ashley Chao Cardeso.
Unidad Nacional Coordinadora de Farmacovigilancia.
CDF, Cuba
isma.alfonso @ infomed.sld.cu
Rev Electron Biomed / Electron J Biomed 2009;2:20-29
Comentario del revisor Dr. Martín de Frutos Herranz PhD. Fisiología humana. Escuela Universitaria de Enfermería. Universidad de Burgos. Burgos, España
Comentario del revisor Dr. Enrique Seoane Vázquez. Doctor en Farmacia. Fármacoeconomista. Profesor de Ohio State University Columbus. Columbus. USA
RESUMEN:
Introducción. La farmacovigilancia es una actividad de salud pública destinada a la identificación, evaluación y prevención de los riesgos asociados a los medicamentos una vez comercializados. En Cuba existe un sistema de Farmacovigilancia con una tasa elevada de reporte de efectos adversos por medicamentos (7000 a 10 000 casos anuales).
Desarrollo. Se realizó un estudio farmacovigilancia, descriptivo, transversal y retrospectivo, que utilizo la Metodología y Procedimientos de Trabajo de la Unidad Coordinadora Nacional de Farmacovigilancia, donde se analizaron todos los reportes de RAM llegados a la unidad durante el 2007 procedentes de todo el país.
Resultados: Se analizaron 6928 notificaciones de reacciones adversas medicamentosas (RAM), notificándose 12963 RAM a razón de 1.9 RAM por notificación, de ellas 4251 fueron reacciones importantes (61.3%) según criterios establecidos por la unidad coordinadora nacional de farmacovigilancia de Cuba. Los sistemas de órganos más afectados durante el año fueron piel y anejos (1774, 25.6%) seguido del tracto gastrointestinal (1438, 20.7%). Entre los fármacos con mayor numero de reportes se encontró captopril (418/6.03%), el ibuprofeno 289 / 4.2% y ciprofloxacina 259/3.7%. Predominaron las RAM probables (68.7%) y moderadas 47.1% y las más frecuentes fueron erupción cutánea, vómitos y fiebre. Entre las asociaciones fármaco - RAM muy importantes y con baja frecuencia de aparición se reportaron en total unas 2953 (35.9%) en el año, de ellas el 9.1% fueron reacciones no descritas en la literatura revisada.
Conclusiones: se detectaron entre una o dos reacciones adversas a medicamentos por cada notificación realizada. Dejando claro la importancia en la selección de los medicamentos y su uso racional. Los fármacos más asociados a las reacciones adversas notificadas fueron captopril, ciprofloxacina e ibuprofeno, la piel y el sistema digestivo fueron los sistemas más afectados y las reacciones adversas que predominaron fueron las moderadas y probables. Hay que monitorizar las asociaciones fármacos - RAM de baja frecuencia así como las reacciones graves o inesperadas que puedan ocurrir para lograr una adecuada valoración beneficio - riesgo de los fármacos de que disponemos en el mercado cubano.
PALABRAS CLAVE: reacciones adversas a medicamentos, farmacovigilancia Cuba, efectos indeseables.
SUMMARY:
Introduction: Pharmacovigilance is an activity of public health for the identification, assessment and prevention of risks related to medicines once marketed. In Cuba there is a pharmacovigilance system with a high reporting rate of adverse drug effects (7000 to 10 000 cases annually).
Methods: We developed a descriptive, transversal and retrospective, pharmacovigilance study, which used the methodology and working procedures of the Cuban Coordinating Unit of Pharmacovigilance, and analyzed all reports of ADR received in 2007 country wide.
Results: We analyzed 6928 reports of adverse drug reactions (ADRs) which included 12,963 adverse effects, with a rate of 1.9 ADR per report form. Among them 4251 were significant reactions (61.3%) according to criteria established by the coordinating unit of pharmacovigilance in Cuba. The most affected organ systems during the year were skin and appendages (1774, 25.6%) followed by the gastrointestinal tract (1438, 20.7%). The drug with the highest number of reports was captopril (418/6.03%), followed by ibuprofen (289/4.2%) and ciprofloxacin (259/3.7%). According to intensity, mild ADRs predominated (68.7%) and the other 47.1% corresponded to moderate ones. The most frequent adverse effects were cutaneous eruption, vomiting and fever. Very important associations drug - ADR of low frequency of occurrence were reported (2953/35.9%), from them 9.1% were reactions not described in the literature reviewed.
Conclusions: The Cuban system develops a serious work on drug surveillance; there is no drug without adverse effects, making clear the importance in the selection of medicines and their rational use. The follow up of associations drug-ADR serious and low frequency or unexpected, is necessary to achieve an adequate benefit-risk evaluation.
KEY WORDS: adverse drug reactions, pharmacovigilance, adverse effects, drug surveillance.
INTRODUCCIÓN
La Farmacovigilancia ha sido y es, una materia de las ciencias de la salud con un alto contenido técnico y científico, pero que además impacta directamente sobre la sociedad. Es el conjunto de procedimientos y actividades encaminadas a la detección registro, notificación e información de reacciones adversas, ocasionadas por los medicamentos después de su aprobación y registro. Esto se realiza con el fin de determinar posible causalidad, frecuencia de aparición, gravedad y establecer las medidas preventivas que llevan al uso más racional de medicamentos y a la optimización de la relación Beneficio-Riesgo. Además nos permite identificar nuevos datos sobre riesgos y prevenir daños en los pacientes1
La incidencia de reacciones adversas medicamentosas (RAM) encontrada en diversos estudios varía entre el 1% y el 30% debido a la utilización de diferentes metodologías para la detección y evaluación de las RAM. Sin embargo la mayoría de los estudios prospectivos muestran que la incidencia de RAM en los pacientes hospitalizados (excluyendo los pacientes con reacciones leves) es entre el 10% y el 20%2-3.
La admisión de pacientes a los hospitales por causa de reacciones adversas a medicamentos es entre el 3% y el 7%. Las muertes inducidas por medicamentos son raras y ocurren en el 0.5% y el 0.9% de los pacientes hospitalizados4-5. En Cuba el sistema de farmacovigilancia esta integrado por un total de 16 unidades provinciales. Se ha implementado en todo el país un programa de vigilancia para todos los profesionales y técnicos de la salud, con un único método de validación e identificación de los riesgos asociados a los medicamentos comercializados6.
El desarrollo de la Farmacoepidemiología en Cuba en el año 1996, a través de su centro rector, el Centro para el Desarrollo de la Farmacoepidemiología (CDF) surge por la necesidad de contar con una disciplina que abarcara todos los aspectos relacionados con el medicamento durante su transito, desde la producción hasta el consumo. Descansando su estructura en una red nacional formada por 175 centros municipales de Farmacoepidemiología, ubicados en una farmacia seleccionada en cada municipio y que a partir de ese momento se conoce como Farmacia Principal Municipal (FPM)6.
El CDF cuenta entre sus principales líneas de trabajo con la Farmacovigilancia y su Unidad Nacional Coordinadora7. Para esto se estableció la metodología a seguir en caso de notificación de sospecha de reacción adversa a medicamentos nacionales o importados, así como la Medicina Natural y tradicional7.
Una reacción, al contrario de un acontecimiento, se caracteriza por la sospecha de una relación causal entre el fármaco y el episodio, atendiendo a la valoración de imputabilidad que haga el profesional sanitario8-10.
El uso extendido del medicamento establece el alcance definitivo de los riesgos (efectos adversos) y de los beneficios (eficacia terapéutica) en sus diferentes indicaciones terapéuticas. Esto muestra la importancia de la farmacovigilancia para controlar el comportamiento del medicamento una vez que ha sido aprobado para su uso por la autoridad sanitaria9.
Es reconocido el hecho de que no siempre se utilizan correctamente los medicamentos. Diferentes factores confluyen para generar esta situación, como la innumerable cantidad de fármacos que aparecieron en los últimos años, la información sesgada originada casi siempre en la industria farmacéutica y la falta de un análisis crítico de la información necesaria para una correcta selección de los medicamentos. Todo ello lleva a situaciones, a veces graves, con el uso de medicamentos8-11.
Es por ello que el sistema cubano de farmacovigilancia permite alertar ante determinadas situaciones al Ministerio de Salud Publica para la toma de acciones específicas por ejemplo: retener lote de un medicamento, retirar un medicamento de la red asistencial por problemas de seguridad, etc. Además de ofrecer información que sirva de base para la docencia del personal de salud y para estudios epidemiológicos de fármacos. También genera señales de alerta sobre el comportamiento de los medicamentos en la población9-11. Todas estas informaciones son necesarias y de gran utilidad para la agencia reguladora de medicamentos (CECMED) en la toma de decisiones7.
Es por ello que esta investigación se propuso analizar el comportamiento de las Reacciones Adversas a Medicamentos en Cuba durante el año 2007, identificándose los fármacos más sospechosos de producir reacciones adversas y clasificando las reacciones adversas según severidad, causalidad y frecuencia.
MATERIAL Y MÉTODOS:
Se realizo un estudio de farmacovigilancia descriptivo, transversal y retrospectivo donde se analizaron todos los reportes de RAM llegados a la base de datos nacional en la unidad nacional coordinadora de farmacovigilancia de Cuba durante el 2007 procedentes de todo el país.
Para ello se utilizo la Metodología y Procedimientos de Trabajo de la Unidad Coordinadora Nacional de Farmacovigilancia12 la cual citamos a continuación. 1. Método de notificación espontánea de RAM y envío de notificaciones de sospechas:
Las reacciones fueron codificadas y clasificadas según sistema de órganos de acuerdo al diccionario de reacciones adversas de la OMS (WHO Adverse Reaction Dictionary) y los fármacos de acuerdo al sistema ATC (Anatomical Therapeutical Chemical Classification). Se utilizaron los criterios de causalidad nombrados por la OMS (definitiva, probable, posible, condicional y no relacionada) y de acuerdo a su gravedad se clasificaron las RAMs en: leves: cuando los síntomas y signos fueron fácilmente tolerados y no requierieron cambio de terapéutica ni antidoto terapia. Moderadas: cuando hay malestar suficiente que interfiere con la actividad usual, y requirieron observación o cambio de terapéutica y no necesariamente se precisó la suspensión del fármaco. Graves: cuando se puso en peligro la vida del paciente y por tanto requirieron la suspensión del fármaco causante de la reacción y la administración de un tratamiento específico para contrarrestarla. Letales: cuando contribuyeron directa o indirectamente a la muerte del paciente13. La información obtenida fue procesada a partir de base de datos nacional de farmacovigilancia en el programa Excel, donde existe un campo que muestra si la reacción adversa reportada fue causa de ingreso hospitalario, lo cual nos aproxima al conocimiento de los reportes de RAM que motivaron ingreso en unidades asistenciales hospitalarias. Se utilizaron como medidas de resumen los números absolutos y porcentajes. Los resultados fueron presentados en tablas y gráficos.
RESULTADOS:
La Tabla 1 muestra la frecuencia de casos de reacciones adversas que motivaron ingreso hospitalario, y la detección de RAM moderadas y graves, reportadas en la base de datos nacional de farmacovigilancia, entre los años 2003-2007.
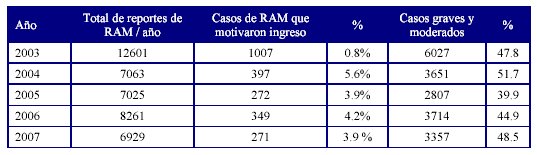
Fuente: Balance 2007. Unidad Coordinadora Nacional de Farmacovigilancia3.
Durante el año 2007 se recibieron 6929 notificaciones de RAM, notificándose 12963 RAM a razón de 1.9 RAM por notificación, de ellas 4251 fueron reacciones adversas importantes para un 61.3% (según criterios para determinar RAM importantes de la UCNFv, en las Normas y procedimientos de trabajo del Sistema cubano de Farmacovigilancia) 12. La tasa de notificación anual fue de 615 notificaciones por millón de habitantes.
En notificaciones del año 2007, según grupos de edades, predominaron las RAM en adultos 59.8%, seguido de la población geriátrica con un 20.5% y los niños con un 19.4%. La distribución por sexo siguió igual comportamiento que en años anteriores, siendo el sexo femenino el más relacionado con sospechas de RAM (4436 notificaciones, 64,0%).
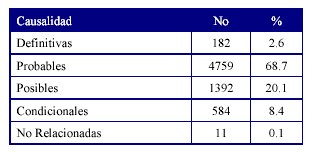
La relación de causalidad según el algoritmo de Karch y Lasagna13 se estableció para las RAM (Tabla 2). El 68,7% de las RAM se consideran reacciones probables.
En la Tabla 3 se muestran la distribución de las notificaciones según severidad durante los años 2005, 2006 y 2007.
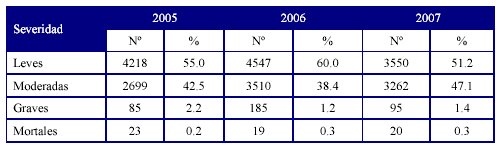
Fuente: Balance 2007. Unidad Coordinadora Nacional de Farmacovigilancia
Los sistemas de órganos más afectados durante el año fueron piel y anejos (1774, 25.6%), gastrointestinal (1438, 20.7%), sistema nervioso central (1024, 14.8%), general (801, 11.6), cardiovascular (688, 9.9%) y respiratorio (519, 7.5%).
Las RAM más frecuentes fueron erupción cutánea, vómitos, fiebre, cefalea, epigastralgia, tos, taquicardia, mareos, hipotensión, náuseas, urticaria y disnea. Las RAM fueron en su mayoría leves y conocidas14-15.
Se reportaron un total de 362 notificaciones a tratamientos de medicina natural y tradicional, representando el 5.2% del total de notificaciones. Este tipo de RAM aumento considerablemente en relación al año anterior, considerandose uno de los logros alcanzado durante el año.
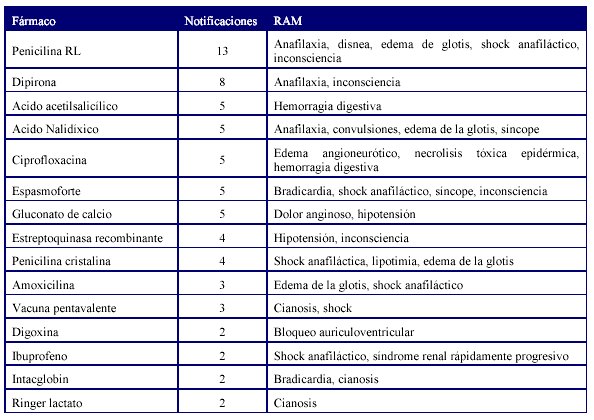
La Tabla 4 muestra los medicamentos que más se reportaron con RAM graves y tipo de RAM.
Los fármacos aminofilina, ampicilina, anís estrellado, atenolol, captopril, carbamazepina, cefotaxima, ceftazidima, ciclofosfamida, cisdiscloro diamino platino, citoprot P, dextrosa 50%, diatrizoato compuesto, enalapril, ifosfamida, ketamina, metoclopramida, nitroglicerina, penicilina benzatinica, propofol, salbutamol, teofilina, timolol, tioridazina, vancomicina, vincristina y warfarina también presentaron reacciones graves, que en total supusieron 95 notificaciones de RAM graves que fueron reportadas en las primeras 24 horas de su conocimiento.
En la tabla 5 se muestran las sospechas de reacciones adversas medicamentosas con desenlace mortal en el año 2007.
Entre las asociaciones Fármaco - RAM muy importantes y con baja frecuencia de aparición se reportaron en total unas 2953 (35.9%) en el año, de ellas el 9.1% fueron reacciones no descritas en la literatura revisada. (Formulario Nacional de Medicamentos de Cuba)16. Los fármacos que más produjeron estos efectos se muestran en la tabla 6.
En Cuba existe un sistema de Farmacovigilancia con una tasa elevada de reporte de efectos adversos por medicamentos (7000 a 10000 casos anuales). A través de los años el sistema ha perfeccionado la detección y análisis de los efectos adversos y ha aumentado el porcentaje de efectos adversos moderados y graves, que generalmente implican la atención de urgencia y/o ingreso hospitalario. A partir de la definición del concepto de RAM importante en septiembre del 2000 en Cuba se comenzó a ver una tendencia a disminuir la notificación de reacciones leves y aumentar las de moderadas, graves y mortales, y se produce un aumento de la calidad de los reportes enviados por las provincias, lo cual se muestra con los datos mostrados en los resultados de este estudio relacionados con la frecuencia de ingresos por RAM y severidad reportadas al Sistema Cubano de Farmacovigilancia durante los años 2003-2007.
De igual forma más de la mitad de los reportes fueron considerados reacciones adversas importantes que según los criterios del sistema cubano engloba a todos aquellos reportes en niños menores de 1 año y en embarazadas; reacciones adversas relacionadas con la vacunación y con la medicina natural y tradicional; aquellas reacciones adversas que comprometan la vida del paciente o que produzcan la muerte; así como reacciones adversas moderadas que afectan los sistemas nervioso central, cardiovascular, hemolinfopoyetico, piel y anejos, respiratorio, y genitourinario. El tipo de RAM reportado nos habla de un sistema que ha venido ganando en la calidad del reporte.
Los pacientes más afectados fueron del sexo femenino, correspondiendo con lo reportado en la literatura1,4,14-15. Esto puede estar relacionado con el mayor número de fármacos a los que están expuestas las mujeres, y por un uso inapropiado de los medicamentos mediante la automedicación.
En relación los grupos de edad, predominaron los reportes de RAM en los adultos; no se comportó de igual forma a lo descrito tradicionalmente en la literatura1,4,14-15, pues son los ancianos la población de mayor riesgo, debido a que los ancianos consumen más medicamentos y no cuentan fisiológicamente con todas las condiciones necesarias para soportar la agresión inminente de estos fármacos; aunque cabe señalar que muchas de estas reacciones se pueden prevenir si se realiza una adecuada prescripción y vigilancia de estos pacientes. Esto podría ser debido a un subregistro de la notificación de las reacciones adversas en la población de ancianos lo cual es una limitación del método de notificación espontánea de RAM. El problema del subregistro también afecta a las RAM en la población pediátrica que posee características propias como la inmadurez enzimática que favorecen la aparición de reacciones adversas.
Predominaron las RAM probables, debido a que en estos pacientes no existió reexposición ni había una causa alternativa que justificara el cuadro clínico; seguidas de las RAM posibles donde si existió una causa alternativa. Solamente una tercera parte de las RAM se clasificaron como definitivas, hecho que ha sido descrito en la literatura ya que para que la reacción sea clasificada de ese tipo tiene que haber reexposición y reaparición de la reacción, y no es ético reexponer al paciente a un fármaco cuando se sospecha una RAM.
Con respecto a la severidad de las RAM, se reportaron reacciones adversas leves seguidas de las moderadas. Las reacciones adversas graves que pusieron en peligro la vida de los pacientes estuvieron relacionadas en su mayoría con antimicrobianos y antiinflamatorios no esteroideos y reacciones de hipersensibilidad, tipo B, la cuales no son predecibles y están asociadas a una elevada mortalidad como se constata en la literatura.
Los reportes de reacciones adversas mortales se relacionaron fundamentalmente con fármacos antineoplasicos y antimicrobianos. Al analizar la imputabilidad en cada caso pudimos concluir que en la mayoría de las RAM la relación de causalidad se clasificó como posible por cuanto la patología de base u otro/s fármacos pudieron estar relacionados con la causa de muerte de los pacientes. Hay que señalar que la penicilina rapilenta constituyó el fármaco con mayor número de reportes de reacciones adversas graves manifestadas por reacciones de hipersensibilidad.
En 2009, el sistema cubano ha continuado trabajando en perfeccionar los filtros de revisión de notificaciones a nivel municipal y provincial, en afianzar los grupos de trabajo multidisciplinarios y en desarrollar nuevos métodos de análisis como el método bayesiano de generación de señales, así como en el mantenimiento de la capacitación, investigaciones, publicaciones y retroalimentación a su red12-13. Se observa también un aumento en la notificación de efectos adversos de baja frecuencia de aparición. La retroalimentación del sistema y la comunicación del riesgo han llegado hasta los notificadores y profesionales sanitarios en general, y se redactaron notas informativas a profesionales sanitarios dando a conocer las características del problema (por ejemplo nota informativa de piroxican en el 200717 y de agonistas dopaminérgicos en el 200818) y las recomendaciones para la prevención de los efectos indeseables.
Este trabajo posee como limitación que el método empleado es la notificación espontánea de reacciones adversas que, como sabemos, es un método de bajo coste pero que depende mucho de la voluntad del personal sanitario para notificar las reacciones adversas, así como de los conocimientos y la importancia que se le atribuya al tema, por lo cual es su principal desventaja la infranotificacion19-20.
Los objectivos futuros están encaminadas a la detección de RAM moderadas, graves y mortales, además de baja frecuencia de aparición, sobretodo aquellas que se consideren señales, para lograr una adecuada valoración beneficio-riesgo de los fármacos de que disponemos en el mercado cubano, además de la realización de investigaciones donde se combinen métodos de farmacovigilancia activos y pasivos para conseguir un mayor número de reportes. Debe mantenerse la retroalimentación a los profesionales sanitarios y fomentar la discusión de los resultados de este estudio en la comunidad médica.
Se detectaron entre una a dos sospechas de RAM por cada notificación realizada. Predominando las RAM de pacientes de sexo femenino y en el grupo de adultos. Las reacciones adversas más frecuentes fueron erupción cutánea seguida por los vómitos.
Predominaron las reacciones adversas leves y probables. Entre las asociaciones fármaco - RAM muy importantes y con baja frecuencia de aparición se reporto como fármaco mas frecuente el captopril.
2. Viewpoint. Parte 1. Vigilando hacia medicinas más seguras. Uppsala Monitoring Centre WHO Collaborating Centre for International Drug Monitoring 2003:3-19.
3. Moore N, Lecointre D, Noblet C, Mabille M. Frecuency and cost of serious adverse reactions in a department of general medicine. Br J Clin Pharmacol 1998; 45: 301-308.
4. Pouyanne P, Haramburu f, Imbs l, Beagud B. Admission to hospital caused by adverse drug reactions: cross sectional incidence study. BMJ 2000; 320:1036.
5. Jiménez L G, Debesa G F, Ávila P J, Bastanzuri V T. Comportamiento de las reacciones adversas a los analgésicos y antiinflamatorios no esteroideos notificados por el sistema cubano de farmacovigilancia. Primer semestre del año 2001. Boletín Fármacos 2002; 5 (2): 1-4.
6. Debesa F, Jiménez G, Pérez J. Vigilancia farmacológica en cuba. Situación actual. Boletin Fármacos, 2001; 4(1) Disponible en: www.boletinfarmacos.org
7. Jiménez L G, Debesa G F, Gonzalez D BE, Avila P J, Pérez P J. El sistema cubano de farmacovigilancia, seis años de experiencia en la detección de efectos adversos. Rev Cubana Farm. 2006; 40 (1).
8. Valsecia M. Farmacovigilancia y mecanismos de reacciones adversas a medicamentos. Disponible en: http://med.unne.edu.ar. Fecha de acceso Abril 2007.
9. Laporte JR, Carné X. Metodología epidemiológica básica en farmacovigilancia. En: Laporte JR, Tognoni G, eds. Principios de epidemiología del medicamento. 2. ed. Barcelona: Masson-Salvat Medicina, 1993:111-130.
10. Laporte JR. Principios básicos de la investigación clínica. 2. ed. Barcelona: Astrazeneca; 2001: 161-190.
11. Lazarou J. Incidence of adverse drug reactions in hospitalised patients: a meta-analysis of prospective studies. JAMA 1998; 279:1200-1205.
12. Normas y Procedimientos de trabajo del Sistema Cubano de Farmacovigilancia". Unidad Coordinadora Nacional de Farmacovigilancia. CDF 2003.
13. Naranjo CA, Busto UE. Reacciones adversas a medicamentos. En: Naranjo CA, ed. Métodos de farmacología clínica. Toronto: El Service Science, 1992: 330-348.
14. Debesa F, Jiménez G, Pérez J, Avila J. Principales resultados del sistema cubano de farmacovigilancia en el año 2002. Boletín Fármacos. 2003; 6(3). Disponible en: www.boletinfarmacos.org .
15. Jiménez G, Debesa F. Medicamentos y Riesgos.: Revista Cubana de Farmacia 2002; 36 (Suplemento especial No 2): 217.
16. Colectivo de autores. Formulario Nacional de Medicamentos. CDF-MINSAP. Cuba 2006.
17. Alfonso I, Jiménez G, Ávila J. Comportamiento de los efectos adversos del Piroxicam. Cuba 2003 - 2007. Boletín Fármacos, 2008;11(2). Disponible en: http://www.boletinfarmacos.org/042008/advertencias_sobre_medicamentos_ investigaciones.asp
18. Alfonso I, Jimenez G, Chao A, Ávila J. Seguridad de los Agonistas Dopaminérgicos Ergóticos en Cuba. 2003-2008. Boletín Fármacos, 2009; 12(1). Disponible en:
http://www.boletinfarmacos.org/022009/advertencias_sobre_medicamentos.asp
19. Organización Mundial de la Salud. Vigilancia de la seguridad de los medicamentos. Guía para la instalación y puesta en funcionamiento de un Centro de Farmacovigilancia. The Uppsala Monitoring Centre, Sweden 2001; 23.
20. Goodman & Gilman's The Pharmacological Basis of Therapeutics (CD-ROM) - 11th ed. (2006).
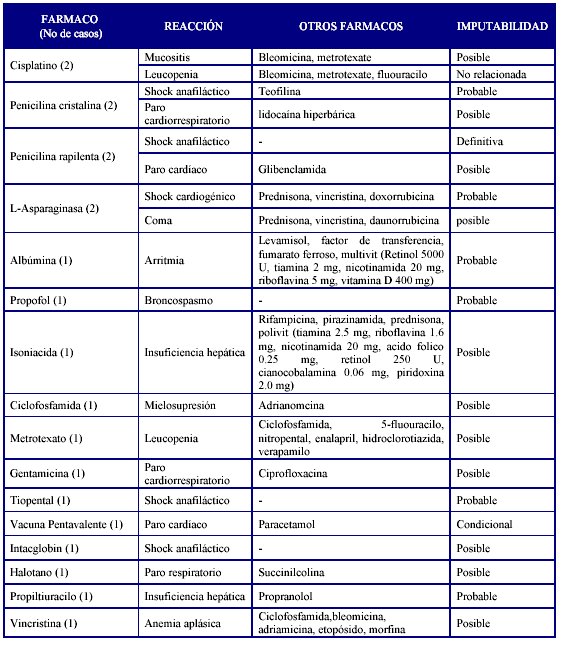
Fuente: Balance 2007. Unidad Coordinadora Nacional de Farmacovigilancia
En total el presente año cerró con 20 sospechas de reacciones adversas mortales, prácticamente igual número que en el año anterior, de igual manera, los antimicrobianos mantienen su comportamiento.
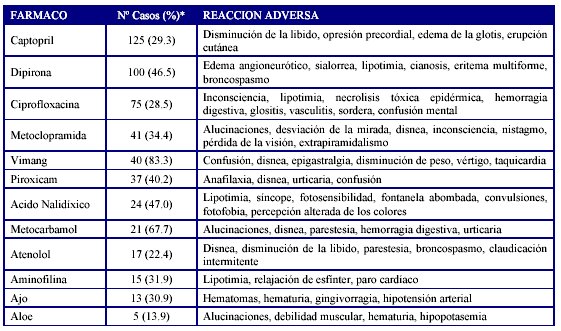
* Del total de reportes del fármaco. Fuente: Balance 2007. Unidad Coordinadora Nacional de Farmacovigilancia
DISCUSIÓN:
CONCLUSIONES
REFERENCIAS
1. Viewpoint Part 2. Watching for safer medicines, the scientific and technical story. Uppsala Monitoring Centre: WHO Collaborating Centre for International Drug Monitoring 2004: 14-27