Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
- La presencia de nuevas cepas que causan brotes de gripe en algún lugar del mundo.
- La disponibilidad de una cepa de alto rendimiento para la fabricación y de reactivos para la normalización.
- El número de seroconversiones o aumento significativo del título de anticuerpos sea > del 40%.
- Que el incremento del título medio sea > 2.5.
- Que la proporción de sujetos consiguiendo un valor de > 40 en inhibición de hemaglutinación (IH) o de > 25 mm2 en el caso de inmunodifusión radial simple (SRD) deba ser > 70%.
- El número de seroconversiones o aumento significativo del título de anticuerpos sea mayor del 30%.
- Que el incremento del título medio sea > 2.
- Que la proporción de sujetos consiguiendo un valor de > 40 en inhibición de hemaglutinación (IH) o de > 25 mm2 en el caso de inmunodifusión radial simple (SRD) deba ser > 60%.
- Vacunas de virus enteros. Fueron las primeras vacunas disponibles desde 1950 y están constituidas por virus enteros inactivados con procedimientos químicos. Además de los componentes antigénicos específicos (hemaglutinina y neuraminidasa) llevan otros muchos componentes celulares por lo que la reactogenicidad es elevada. Hoy día prácticamente no se utilizan en nuestro medio.
- Vacunas de virus fraccionados. Se obtienen mediante la ruptura de la membrana lipídica del virus con disolventes o detergentes, fraccionándola y purificando los componentes antigénicos protectores (hemaglutinina y neuraminidasa). Además llevan otros componentes virales como proteínas, lípidos y ARN. Son ampliamente utilizadas en nuestro medio y presentan una mejor tolerancia que las anteriormente comentadas.
- Vacunas de subunidades. Están constituidas por los antígenos inmunizantes de superficie purificados, hemaglutinina y neuraminidasa exclusivamente, eliminándose en su composición el resto de productos virales que contenían las anteriores vacunas, por lo que su reactogenicidad es muy escasa. Son igualmente muy utilizadas en nuestro medio.
- Vacunas de subunidades adyuvadas. Son vacunas de subunidades que tienen potenciado su efecto inmune por la adición de un adyuvante (MF59.1). Presentan la ventaja de que su inmunogenicidad es superior y de duración más prolongada que las de las vacunas anteriormente comentadas. Además, la repetición de la inmunización anual mejora la respuesta inmune, por lo que están especialmente indicadas en personas con respuesta inmunológica deficitaria (mayores de 65 años y en pacientes inmunodeprimidos o con enfermedades crónicas). En España sólo está autorizada su administración en personas mayores de 64 años.
- Vacunas de subunidades virosómicas. Son igualmente vacunas de subunidades que utilizan partículas similares a la cápsula viral (virosomas) donde se integran los antígenos protectores (hemaglutinina y neuraminidasa), imitando de esta forma el mecanismo de presentación que ejerce el virus salvaje. Condicionan una potente respuesta inmune y pueden administrarse en cualquier edad, a partir de los 6 meses de vida.
ACTUALIZACIÓN DE LAS VACUNAS ANTIGRIPALES
EN EL MANEJO DE LA ENFERMEDAD GRIPAL
Jorge Vázquez Valcuende, José María Eiros Bouza MD PhD,
Antonio Sanchez Porto MD.
Universidad de Santiago de Compostela.
Facultad de Medicina de la Universidad de Valladolid.
Hospital de La Línea, Cádiz.
España
eiros @ med.uva.es
Rev Electron Biomed / Electron J Biomed 2009;3:58-64.
Comentario del revisor Prof. Valentín del Villar Sordo PhD. Catedrático de Medicina y Jefe de Servicio de Medicia Interna del Hospital de Soria. España
Comentario del revisor Beatriz Cuevas Ruiz PhD. Comisión de Investigación. Hospital General Yagüe. Burgos. España
RESUMEN
El presente trabajo representa una revisión conceptual sobre las dos aproximaciones teóricas para la vacunación antigripal. Globalmente consideradas las vacunas antigripales se basan en la utilización de virus inactivados o de virus atenuados. Las primeras pueden a su vez categorizarse en cinco modalidades: las que albergan virus completos, las elaboradas con virus fragmentados, las constituidas a base de subunidades, las que contienen adyuvantes y las virosomales. De manera complementaria se presenta los pasos en los procesos de fabricación con particular referencia a las vacunas producidas en huevos embrionados
PALABRAS CLAVE: Gripe. Vacunas. Inactivadas. Atenuadas
SUMMARY: UPDATE OF THE VACCINES IN THE MANAGING OF THE INFLUENZA
The present paper represents a conceptual review on both theoretical approximations for the anti-influenza vaccination. Globally considered the influenza vaccines are based on the utilization of virus inactivated or attenuated viruses. The firsts ones can be categorized in turn in five modalities: those who shelter complete virus, elaborated with fragmented virus, the constituted ones based on subunits, which they contain adyuvants and the virosomics. In a complementary way one presents the steps in the manufacturing processes with individual reference to the vaccines produced in eggs embrionated.
KEY WORDS: Influenza. Vaccines. Inactivated. Atenuated.
INTRODUCCIÓN
La gripe provoca en España cerca de 12 millones de infecciones al año, de las cuales unos 4 millones de casos, el 10% del total de la población española, requiere atención médica, 40.000 acaban hospitalizados y 3.000 personas fallecen1. Aproximadamente, el 25% de los procesos respiratorios febriles agudos se deben al virus de la gripe2. Y aunque la mayor incidencia se produce en las personas de 5 a 19 años, las complicaciones y la letalidad son bajas en este grupo de edad y se concentran en las personas mayores de 50 años (el 90% de los fallecimientos por complicaciones respiratorias se producen en los mayores de 65 años)3,4. Por este motivo, durante los meses de otoño, las Comunidades Autónomas llevan a cabo una campaña pública de vacunación antigripal, vacunando a aquellos grupos de población con mayor riesgo de complicación por infección gripal, principalmente ancianos (mayores de 65 años) y personas con patologías crónicas subyacentes.
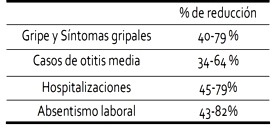
Los resultados de los estudios fármaco-económicos, han puesto en evidencia la coste-efectividad de la vacunación antigripal reduciendo en un 60% los casos confirmados por el laboratorio en ancianos, el 80% de los casos confirmados en adultos jóvenes y hasta un 50% de la mortalidad por cualquier causa en los mayores de edad avanzada4. En términos económicos, la razón de ser de la vacunación antigripal, viene dada por los resultados de los parámetros medidos, (Tabla 1) que transforman los costes de vacunación en una inversión rentable.
en términos de disminución de los parámetros dependientes de la gripe5,6.
Por tanto, se establece un perfil fármaco-económico favorable para la vacunación antigripal en ancianos, resaltando el coste-efectividad del proceso en personas mayores sanas entre los 65 y 74 años7, respaldando el consenso de que la vacunación en pacientes de edad avanzada, incluidos los mayores sanos, tienen beneficios en cuanto a la calidad de vida y en cuanto al ahorro de costes asociados.
Selección de las cepas vacunales
De una manera deliberada, reseñamos que la Organización Mundial de la Salud (OMS) cuenta con cuatro Centros Internacionales de la gripe con sede en los EE.UU., Australia, Japón y Reino Unido, que trabajan en colaboración con 110 Centros Nacionales de la gripe en 83 países8 y cuya misión es aislar y caracterizar los virus gripales circulantes en su área geográfica. Estos virus son luego comparados entre sí en estos cuatro Centros colaboradores de referencia, a fin de detectar las nuevas variantes y seleccionar las que deben ser incluidas en la vacuna de la temporada siguiente.
La OMS organiza una consulta a mediados de Febrero para formular la recomendación sobre la composición de las vacunas antigripales inactivadas del siguiente invierno en el hemisferio Norte (de Noviembre a Abril). Cada Septiembre, emite una segunda recomendación sobre las vacunas que se deberán usar durante el siguiente invierno en el hemisferio Sur (de Mayo a Octubre).
Como consecuencia de la deriva genética de la gripe y de la consecuente recomendación de nuevas cepas que la OMS efectúa anualmente, los titulares de las actuales vacunas de la gripe solicitan anualmente una variación de su autorización para adaptarse a la recomendación de la OMS. Las nuevas vacunas se obtienen tras la preparación de las nuevas semillas de las cepas H1N1 y H3N3 mediante la obtención de reagrupados de las cepas seleccionadas por la OMS (que donan los ARNs de la Hemaglutinina y Neuraminidasa) con la cepa A circulante en esa temporada.También se selecciona una nueva cepa del tipo B. Las semillas son preparadas por Centros Colaboradores de la OMS y se ponen a disposición de los Laboratorios fabricantes.
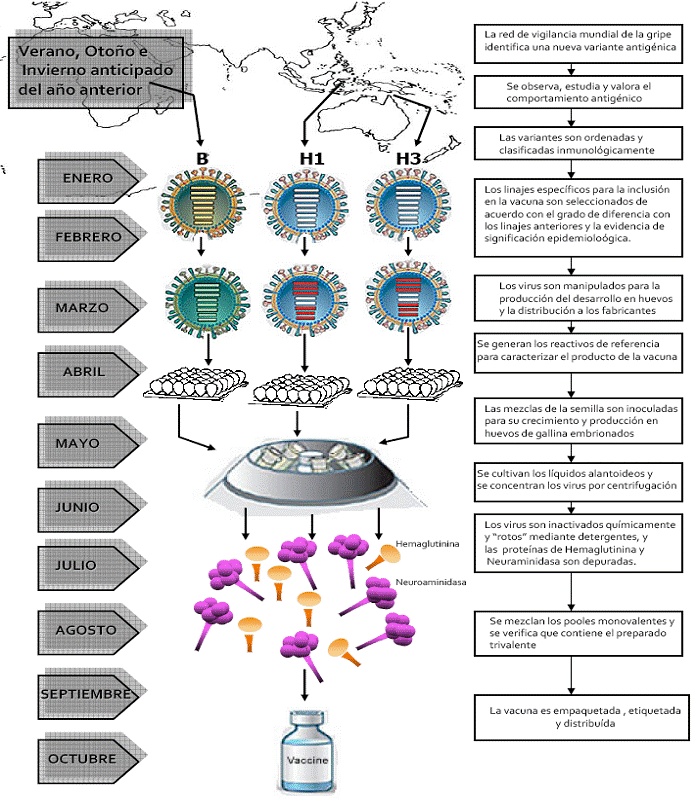
Figura 1. Cronograma del proceso anual de desarrollo, fabricación y distribución de las vacunas antigripales.
Fuente: representación modificada de N Engl J Med 2004; 351:2037-40
Las recomendaciones sobre las cepas de la gripe A y B que se deberían usar en la fabricación de vacunas para la siguiente temporada tienen alcance mundial. Para realizar la selección anual de los virus se tienen en cuenta los siguientes datos:
Como entre los principales tipos de virus que circulan por todo el mundo se incluye un tipo A (H1N1), un tipo A (H3N3) y un tipo B, las vacunas se formulan de forma que se incluya un subtipo de cada una de estas tres categorías con características antigénicas similares a las de las cepas corrientes en circulación. Observamos en la Figura 2, la nomenclatura oficial de una cepa de virus gripal.
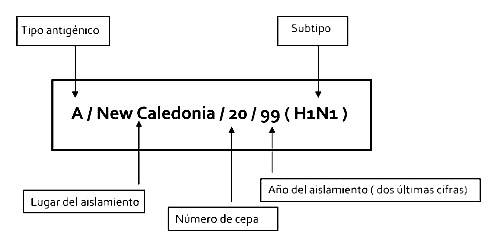
Figura 2. Nomenclatura de las cepas de los virus de la gripe. Fuente: Elaboración propia
Requisitos para la fabricación
Como la Hemaglutinina estimula la respuesta inmunitaria de protección ante la infección por el virus de la gripe, es básico que la vacuna antigripal contenga la Hemaglutinina apropiada. La OMS emite una recomendación general sobre la cantidad de antígenos que deben contener las vacunas y, en la actualidad, la mayoría de vacunas del mundo contienen 15µg/cepa/dosis9.
Las vacunas que deben ser aceptadas en toda la UE tienen que ajustarse a los requisitos de la Farmacopea Europea. Todos los años deben llevarse a cabo ensayos clínicos, pues la composición de las vacunas cambia cada año. Estos ensayos han de demostrar que la vacuna cumple unos requisitos en cuanto a capacidad inmunógena, seguridad y eficacia10. En países no pertenecientes a la UE, estos ensayos anuales no se exigen.
No existe un parámetro subrogado de protección, es decir, no hay un valor de respuesta de anticuerpos que pueda ser considerado como predictivo de protección tras la vacunación. Por otra parte, la protección puede valorarse teniendo en cuenta la protección frente a la infección, frente a la enfermedad, y frente a las complicaciones severas de la enfermedad, incluida la muerte. Lo que parece claro es que no es posible cada año un estudio de eficacia clásico de protección con un grupo placebo de control. Ante esta dificultad, en EE.UU. se acepta cada año el cambio sin una regulación especial de la valoración de la capacidad inmunogénica de la vacuna.
Existe una directriz que armoniza los estudios que deben realizarse en esta adaptación (Note for guidance on harmonisation of requirements for influenza vaccines. CPMP/BWP/214/96, 12 March 1997. Documentación disponible en http://www.emea.europa.eu/pdfs/human/bwp/021496en.pdf Esta armonización afecta a las vacunas fabricadas en huevos embrionados (en este momento todas las vacunas comercializadas en España), y existen también recomendaciones para vacunas inactivadas producidas en cultivos celulares (Cell culture inactivated influenza vaccines. CPMP/BWP/2490/00, 17 January 2002). Documentación disponible en: http://www.emea.europa.eu/pdfs/human/bwp/249000en.pdf.
En Europa, la directriz sobre armonización de vacunas antigripales, establece un ensayo clínico anual que dé soporte a la variación. El ensayo clínico comprende la valoración en dos grupos de al menos 50 individuos cada uno (uno de entre 18 y 60 años y otro de personas de más de 60 años), no vacunados de gripe en los últimos 6 meses, a los que se les toma sangre antes de la vacunación y aproximadamente tres semanas después. Los participantes son vacunados y, aproximadamente a los 28 días de la vacunación, se realiza extracción de muestras de sangre y se analiza el suero para detectar la presencia de anticuerpos antihemaglutinina ante las cepas prototipo mediante prueba de inhibición de hemaglutinación (IH).Posteriormente, se valoran reacciones adversas y respuesta de anticuerpos.
En el caso del grupo de personas de entre 18 y 60 años, debe obtenerse que:
Para el grupo de mayores de 60 años estos valores son:
Originalmente, estos criterios eran acumulados, es decir, tenían que cumplirse todos. Actualmente, debido a las dificultades de conseguirlo, hecho que ha ocurrido en alguna ocasión, el criterio se ha rebajado a cumplir cualquiera de ellos, con la particularidad de que alguna vez sólo se cumplió el 3, que es previo a la administración de la vacuna. Es decir la vacuna, cada año, puede generar eficacias diferentes y de muy difícil valoración.
Clasificación y Diferencias
El avance en biotecnología de investigación sobre vacunación antigripal ha desarrollado líneas de trabajo muy diversas con el objeto de mejorar el desarrollo de vacunas antigripales. Algunos esfuerzos se han hecho en el campo de las vacunas DNA, utilizando plásmidos conteniendo los genes relevantes del virus de la gripe11. Las vacunas existentes en la actualidad son fundamentalmente vacunas inactivadas, aunque ya se ha autorizado una vacuna atenuada.
Vacunas Atenuadas
Las vacunas atenuadas generan producción de anticuerpos IgA en la mucosa del tracto respiratorio, y se considera que, en este tipo de vacunas, esta respuesta es la más relacionada con la protección. La producción adaptada a la deriva antigénica se logra mediante la obtención de reagrupados con las cepas recomendadas por la OMS con las cepas atenuadas A y B12 En el año 2003, se autoriza una vacuna atenuada en Estados Unidos para niños, adolescentes y adultos de 5 a 49 años. La vacuna no se debe administrar a personas con historia de Guillain- Barré, embarazadas, ni jóvenes ni niños recibiendo salicilatos. La vacuna es de administración intranasal y parece segura desde un punto de vista de la no transmisibilidad persona a persona13
Vacunas Inactivadas
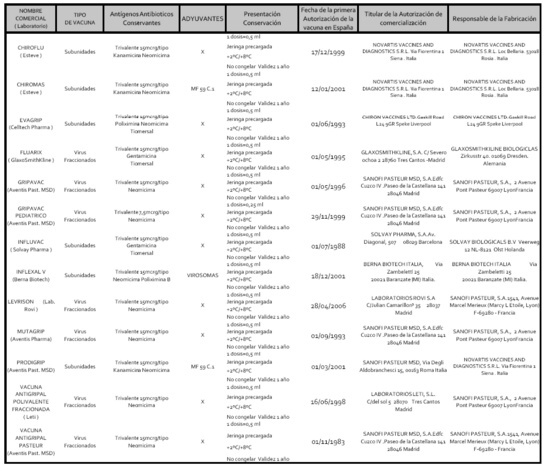
Los virus gripales se hacen crecer en células ó en huevos embrionados y posteriormente se pueden inactivar con b-propiolactona ó formalina. En la actualidad existen disponibles en España diferentes tipos de vacunas antigripales para la administración exclusivamente por vía parenteral. Todas ellas se cultivan en huevos embrionados y están inactivadas. Existen los siguientes tipos de vacunas. Tabla 2:
REFERENCIAS
-
1. Salleras Sanmartí L. Vacunaciones Preventivas. Principios y Aplicaciones. Editorial Masson S.A., Barcelona 1998:344-345.
2. Romero J, Rubio M, Corta! O, Pacheco S, Agudo E, Picazo J. Estudio de las infecciones respiratórias extrahospitalarias. Enfer Infec Microbiol Clin 1997;15:289-298.
3. CDC. Advisory Commitee on Inmunization Practices (ACIP). Recommendations . Prevention and control of influenza . MMWR 2003;52:1-34
4. Salleras L. Impacto sanitario y económico de la vacunación antigripal inactivada. Vacunas 2002;3(Supl 1):38-46.
5. Bridges CB, Thompson W., Meltzer M et al. Effectiviness and costbenefit of influenza vaccination of healthy working adults. JAMA 2000; 284: 1655-1653.
6. Leighton L, Willians M, Aubery D., Parker H. Sickness absence following a campaign of vaccination against influenza in the workplace. Occup Med 1996; 46: 146-150.
7. Nichol KL, Goodman M. Cost effectiveness of influenza vaccination for healthy persons between ages 65 and 74 years. Vaccine 2002; 20: S21-4.
8. Organización Mundial de la Salud. FluNet. Disponible en http//gamapserver.who.int/GlobalAtlas/home.asp
9. Wood JM. Standardization of inactivated influenza vaccines. En: Nicholson KG, Webster RG, Hay AJ, editors. Textbook of Influenza. Blackwell Science, New York,2000:333-345.
10. Comité para Productos Medicinales de Propiedad (CPMP). Anotación para orientar sobre la armonización de requisitos para las vacunas de la gripe. CPMP/BWP/214/96.Disponible en http://www.emea.europa.eu/pdfs/human/bwp/021496en.pdf
11. Ulmer JB. Influenza DNA vaccines. Vaccine 2002; 20 (suppl 2): 574-576.
12. Maassab HF, De Border DC. Development and characterization of cold-adapted viruses for use as live virus vaccines. Vaccine 1985; 3: 355-369.
13. Wright PF, Johnson PR, Karzon DT. Clinical experience with live, attenuated vaccines in children. In Kendal AP, Patriarca PA (eds). Option for the control of influenza. Alan R Liss, New York, , 1986: 243-253.
CORRESPONDENCIA:
Profesor JM Eiros Bouza.
Departamento de Microbiología.
Facultad de Medicina.
Av. Ramón y Cajal 7.
47005 Valladolid. España
e-mail: eiros @ med.uva.es
Recibido: 23 de diciembre de 2009.
Publicado: 31 de diciembre de 2009.