Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
ÚLCERAS ESCROTALES SECUNDARIAS A TRATAMIENTO CON ÁCIDO TRANSRETINOICO (ATRA)
M. Victoria Cuevas-Ruiz, Carmen Jiménez-Alfaro*, Beatriz Cuevas-Ruiz.
Servicios de Hematología-Hemoterapia y *Medicina Interna. Complejo Asistencial Universitario de Burgos.
Burgos, España
bcuevas @ hgy.es
Rev Electron Biomed / Electron J Biomed 2011;1:55-59.
RESUMEN:
El ácido trans retinoico es el fármaco de elección en el tratamiento de la Leucemia Promielocítica Aguda. El efecto secundario más grave del fármaco es el síndrome de diferenciación, pero puede ocasionar lesiones en piel y úlceras escrotales.
Presentamos el caso de un varón con leucemia promielocítica aguda que recibió ATRA y presentó úlceras escrotales
PALABRAS CLAVE: Leucemia promielocítica aguda. ATRA. Úlceras escrotales.
SUMMARY:
All-trans retinoic acid (ATRA) is the drug of choice in the treatment of acute promyelocytic leukemia. The most serious side effect of the drug is the syndrome differentiation, but can cause skin lesions and scrotal ulcers.
We report the case of a male with acute promyelocytic leukemia who received ATRA and scrotal ulceration.
KEY WORDS: Acute Promyelocytic leukemia. All-trans retinoic acid. Scrotal ulceration.
INTRODUCCIÓN
La leucemia promielocítica aguda (LAP) o M3 de la clasificación (FAB French-American-British (FAB) es un tipo de leucemia ya descrita por Hillestad1 caracterizada por la presencia de promielocitos patológicos y una infiltración de blastos menor del 30%2.
La M3 constituye un grupo, en el que se incluyen diversas variantes3. La clasificación de la Organización Mundial de la Salud, reconoce dos subtipos: un grupo con traslocación (15;17) (q22;q21); (PML/RAR?) que englobaría las variantes morfológicas clásica hipergranular y la hipogranular y otro grupo con traslocaciones variantes con implicación en el gen RAR 4. La clasificación morfológica incluye 2 variantes principales que difieren en su presentación clínica y en su pronóstico: la variante hipergranular y la hipogranular3. Además existen otras variantes como la LAP con gránulos basófilos o con gránulos eosinófilos, la LAP hiperbasófila y los tipos similares al mieloblasto5.
4. La clasificación morfológica incluye 2 variantes principales que difieren en su presentación clínica y en su pronóstico: la variante hipergranular y la hipogranular3. Además existen otras variantes como la LAP con gránulos basófilos o con gránulos eosinófilos, la LAP hiperbasófila y los tipos similares al mieloblasto5.
Su frecuencia entre las leucemias agudas es del 5-10 % . Puede presentarse de novo o ser secundaria al uso de fármacos como los inhibidores de la enzima topoisomerasa II6 o mitoxantrone7.
La LPA infantil supone el 7-10 % de todos los casos8.
El pronóstico de los pacientes con Leucemia aguda promielocítica, ha mejorado tras la introducción del tratamiento con all-trans retinoic acid (ATRA)9.
El grupo de De la Serna y col. describe una tasa de remisión completa del 91%, siendo el resto fallos en la inducción y muerte durante la misma. La causa más común de fallecimiento durante al inducción fue la hemorragia (5%) seguida de la infección (2,3%) y del síndrome de diferenciación (1,4%). En el análisis multivariante se identificaron las características que aumentaron el riesgo de muerte por hemorragia como: creatinina anormal, cifra elevada de blastos en sangre periférica y presencia de coagulopatía), por infección: edad mayor de 60 años, sexo masculino y fiebre al debut y del síndrome de diferenciación: Eastern Cooperative Oncology Group [ECOG] score >1 y bajos niveles de albúmina10.
Desde la descripción inicial de la LPA, se observó que un gran número de casos se acompañaban de coagulopatía lo que confiere un pronóstico adverso ya que la mortalidad por hemorragia sigue siendo causa de muerte temprana. La patogénesis de la coagulopatia es compleja e incluye coagulación intravascular diseminada, fibrinolisis y proteolisis provocando principalmente fenómenos hemorrágicos, aunque también pueden presentarse eventos trombóticos11
Se ha descrito una elevada expresión de anexina II en las células leucémicas; ésta es una proteína con alta afinidad por el plasminógeno y por el activador tisular del plasminogeno y también actúa como cofactor de la activación del plasminógeno (tPA). Como resultado ambos, el plasminógeno y el activador tisular del plasminógeno están incrementados en la superficie celular leucémica. La anexina II es expresada en grandes cantidades en las células endoteliales de la microvascularización cerebral, y se ha sugerido que esta elevada la cantidad podría intervenir en la alta incidencia de hemorragia cerebral en LPA en comparación con la hemorragia a otros niveles.
El tratamiento de la coagulopatia es el de soporte, con transfusiones de plaquetas y plasma, crioprecipitado y concentrado plasmático de fibrinógeno; la medida más importante es el pronto inicio del tratamiento con ATRA ante la sospecha diagnóstica de LPA, antes incluso de la confirmación genética12
El ATRA induce maduración y posterior apoptosis de los blastos de la LPA. El tratamiento con ATRA es bien tolerado pero ocasionalmente aparecen efectos secundarios.
Presentamos el caso de un adolescente con LPA y úlceras escrotales secundarias al tratamiento con ATRA.
CASO CLÍNICO
Paciente varón de 17 años de raza caucásica, sin antecedentes personales que acudió en mayo de 2009, por epistaxis, cefalea frontal y fiebre. No refería antecedentes personales de interés.
En la exploración física se objetivó una temperatura de 38.4ºC; petequias en paladar, tobillos y dorso de pies. Se palpaban pequeñas adenopatías inferiores al centímetro en región submandibular izquierda y axilar derecha; en abdomen se palpaba esplenomegalia de 2 cm por debajo del reborde costal.
El hemograma evidenció los siguientes valores: Hb 141 g/l, VCM 85 fl, leucocitos 108,7 x 109/l, plaquetas 42 x 109/l con una morfología de sangre periférica en la que se observaba un 90% de células blásticas de gran tamaño, núcleo lobulado con signo del hachazo, citoplasma basófilo microgranular, con ocasionales bastones de Auer pero sin astillas.
El estudio de coagulación reveló un tiempo de protrombina del 49 %, un tiempo de tromboplastina parcial activado de 27 segundos (control 34 segundos), fibrinógeno 150 mg/dl y Dímeros-D > 20 ng/dl (0.1- 0.3). En la bioquímica destacaba: LDH 2.591 UI/L (240-683) .
Con la sospecha diagnóstica de Leucemia Promielocítica Aguda y Coagulación intravascular diseminada asociada, se inició tratamiento de soporte con plasma, concentrado plasmático de fibrinógeno (Hemocompletan ©), transfusión de aféresis de plaquetas y antibiótico de amplio espectro (Meropenem 1 gr/8 h) previa extracción de hemocultivo y urocultivo.
Se solicitó TAC craneal, no observándose signos de sangrado agudo ni efecto de masa, permaneciendo la línea media centrada. La ecografía abdominal mostraba una ligera hepatomegalia y esplenomegalia.
El aspirado de médula ósea fue informado como infiltrado por un 88% de células blásticas de mediano tamaño, la mayoría con núcleo monocitoide con imagen "en hachazo" y citoplasma finamente granular; así mismo se apreciaban células con citoplasma hipergranular. El diagnóstico fue compatible con Leucemia Aguda Promielocítica variante microgranular.
El inmunofenotipo con reactividad de las células blásticas (90%) frente a los distintos
marcadores fue: cMPO: positivo debil, cCD: negativo, cCD79a: negativo, TdT: negativo, CD34: negativo, HLA DR: 37% +, CD117: 17% +, CD13: positivo++, CD33: positivo++, CD65: negativo, CD123: positivo ++, CD16: negativo, CD11b: negativo, CD15: negativo,CD14: negativo, CD64: negativo, CD63: negativo, Glicoforina A: negativo, CD61: negativo, CD19: negativo, CD7: negativo, CD2: negativo, CD45: positivo débil, CD56: negativo, CD71: negativo.
El cariotipo reveló que de las metafases analizadas presentaban intercambio recíproco de material entre los cromosomas 15q y 17q: 46,XY [9]. 46,XY,t(15;17)(q21;q11)[11]. El estudio de hibridación in situ con sondas específicas de la traslocación (15; 17) mostraba fusión PML/RAR lo que confirmó el diagnóstico de Leucemia Promielocítica Aguda (89% de células patológicas).
Con el diagnóstico de LPA se inició tratamiento según protocolo LPA 2005 de PETHEMA alto riesgo (menos de 60 años y leucocitos superiores a 10 x 109/l). Recibió tratamiento de inducción con Idarrubicina 12 mg/m2 , vía endovenosa los días 2, 4, 6 y 8 asociada a ATRA 45 mg/m2 oral en dos dosis (se redujo la dosis a 25 mg/m2 por edad menos de 20 años) hasta remisión completa. Así mismo, se pautó dexametasona durante 16 días, para evitar el síndrome del ATRA. Recibió tratamiento con Rasburicasa (0.2 mg/kg/día, durante 4 días) como profilaxis del síndrome de lisis tumoral.
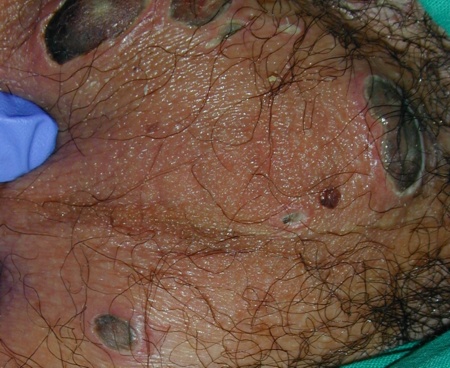
El día 21 del inicio del tratamiento presentó foliculitis en ingle y muslo izquierdo, por lo que se inició tratamiento con Linezolid a dosis de 600 mg/12 horas. 48 horas después se produjo la ulceración de algunos de los folículos; se realizó cultivo de las úlceras y se solicitó valoración por el Servicio de Cirugía General que para descartar gangrena de Fournier, solicitó Ecografía testicular, en la que únicamente se observaba una pared escrotal engrosada, hipervascularizada, fundamentalmente en el lado izquierdo, de aspecto inflamatorio y un TAC pélvico, con el hallazgo de edema escrotal izquierdo con hidrocele reactivo sin signos de gangrena testicular y con presencia de pequeñas adenopatías inguinales bilaterales. 4 días después el paciente quedó afebril (figura 1).
Para facilitar la recuperación de la aplasia postquimioterapia recibió factores estimulantes de colonias granulocíticas (G- CSF) durante 5 días. Al alta se continuó el tratamiento con curas locales con mupirocina e hidrocortisona y no se suspendió el ATRA.
A los 15 días de la aparición de las úlceras escrotales se observó la resolución del cuadro, no reproduciéndose posteriormente a lo largo del tratamiento.
El paciente se encuentra actualmente en remisión completa citogenética y molecular y continúa con el tratamiento de mantenimiento correspondiente al protocolo LPA 2005 de PETHEMA alto riesgo.
DISCUSIÓN
Desde la introducción del ATRA en los esquemas de tratamientos quimioterápicos de la Leucemia Promielocítica Aguda, se han comunicado diversos efectos secundarios del fármaco, la mayoría leves.
El síndrome del ATRA, el mayor efecto secundario se presenta en el 15 % de los pacientes y con la administración de altas dosis de dexametasona de forma temprana se reduce la incidencia hasta el 1-1,5% . Este síndrome consiste en fiebre alta, distres respiratorio e infiltrados pulmonares con leucocitosis, insuficiencia renal, hepática, derrame pleural y pericárdico y edema generalizado13.
Al igual que otros retinoides, los efectos adversos afectan a piel y mucosas, apareciendo sequedad en ambas así como queilitis en el 24 al 65% de los pacientes14.
Así mismo, se ha descrito como efecto secundario la aparición de úlceras escrotales secundarias al uso de ATRA15.
Esta complicación habitualmente se presenta en niños y sobre todo en pacientes asiáticos. Las lesiones pueden aparecer desde el día 10 al 29 del inicio del tratamiento y la mejoría se produce desde los 7 días a los 3 meses de la presentación. En ocasiones la aparición de la úlcera se acompaña de fiebre y se ha descrito la progresión a gangrena de Fournier, posiblemente por sobreinfección de la úlcera escrotal. Se recomienda el tratamiento antibiótico de amplio espectro, curas locales y la asociación de tratamiento con corticoide. En algunos pacientes se suspendió el tratamiento con ATRA16.
Las biopsias de piel realizadas mostraron exclusivamente hallazgos inflamatorios17. implicándose la activación de citoquinas en la producción de las úlceras escrotales por ATRA.
El ATRA induce la producción de citoquinas como TNF-alfa, interleukinas y Interferon gamma, los cuales pueden activar a los leucocitos. También induce la transcripción de genes que codifican moléculas de adhesión leucocitaria, que lesionan directamente los tejidos. Se ha descrito que en algunos casos las úlceras escrotales aparecen concomitantemente con la recuperación de la cifra de los leucocitos17.
Curiosamente estas lesiones aparecen solo durante la inducción y no durante el tratamiento subsecuente16.
Como en los casos publicados, nuestro paciente evolucionó satisfactoriamente, sin necesidad de retirar el tratamiento con ATRA y sin reaparición de las úlceras en los ciclos posteriores ni durante el tratamiento de mantenimiento.
REFERENCIAS
-
1.- Hillestad LK. Acute Promyelocytic leukemia. Acta Med Scand 1957; 159(3):189-194.
2.- Warrell RP Jr, de Thé H, Wang ZY, Degos L. Acute promyelocytic leukemia. N Engl J Med 1993; 329: 177-189.
3.- Castoldi GL, Liso V, Specchia G, Tomasi P. Acute promyelocytic leukemia: morphological aspects. Leukemia 1994; 8: 1141-1146.
4.- Grimwade D, Biondi A, Mozziconacci MJ et al. Characterization of acute promyelocytic leukemia cases lacking the classic t(15;17): results of the European Working Party. Groupe Français de Cytogénétique Hématologique, Groupe de Fraçais de d'Hematologie Cellulaire, UK Cancer Cytogenetics Group and BIOMED 1 European Community-Concerted Action "Molecular Cytogenetic Diagnosis in Haematological Malignancies". Blood 2000; 96: 1297-1308.
5.- Woessner S, Florensa L. La Citología óptica en el diagnóstico hematológico. Ed Acción Médica SA y Fundación de Hematologia y Hemoterapia 2006. Capítulo 8: Leucemias agudas. Introducción al estudio de las leucemias agudas. Clasificación. Descripción de las distintas variedades. Formas especiales. Página 347-444.
6.- Mistry AR, Felix CA, Whitmarsh RJ et al. DNA topoisomerase II in therapy-related acute promyelocytic leukemia. N Engl J Med 2005: 352: 1529-1538.
7.- Hasan SK, Mays AN, Ottone T et al. Molecular análisis of t(15;17)genomic breakpoints in secondary acute promyelocytic leukemia arising after treatment of múltiple sclerosis. Blood 2008; 112: 3383-3390.
8.- Guglielmi, C., Martelli, M.P., Diverio, D. Et al. Immunophenotype of adult and childhood acute promyelocytic leukaemia: correlation with morphology, type of PML gene breakpoint and clinical outcome. A cooperative Italian study on 196 cases. British Journal of Haematology 1998; 102: 1035-1041.
9.- Fenaux, P., Chastang, C., Chevret, S. et al. A randomized comparison of all transretinoic acid (ATRA) followed by chemotherapy and ATRA plus chemotherapy and the role of maintenance therapy in newly diagnosed acute promyelocytic leukemia. Blood 1999; 94: 1192-2000.
10.- De la Serna J, Montesinos P, Vellenga E et al . Causes and prognostic factors of remission induction failure in patients with acute promyelocytic leukemia treated with all-trans retinoic and idarubicin. Blood 2008; 111: 3395-3402.
11.- Tallman MS, Kwaan HC. Reassessing the hemostatic disorder associated with acute promyelocytic leukemia. Blood 1992; 79:543-553.
12.- Stein E, McMahon B, Kwaan H et al. The coagulopathy of acute promyelocytic leukaemia revicited. Best Pract Res Haematol 2009; 22: 153-163.
13.- Fenaux, P., Chastang, C., Chevret, S. et al. A randomized comparison of all transretinoic acid (ATRA) followed by chemotherapy and ATRA plus chemotherapy and the role of maintenance therapy in newly diagnosed acute promyelocytic leukemia. Blood 1999; 94: 1192-2000.
14.- Gillis JC, Goa KL. Tretinoin: A review of its pharmacodynamic and pharmacokinetic properties and use in the management of acute promyelocytic leukaemia. Drugs 1995; 50: 897-923.
15.- Tajima K, Sagae M, Yahagi A, Akiba J, Suzuki K, Hayashi T, Satoh S. Scrotum exfoliative dermatitis with ulcers associated with treatment of acut promyelocytic leukemia with all-trans retinoic acid. Rinsho Ketsueki. 1998 ;39 :48-52.
16.- Naithani, R, Kumar R, Mahapatra M. Fournier's Gangrene and Scrotal Ulcerations During All-Trans-Retinoic Acid Therapy for Acute Promyelocytic Leukemia. Pediatr Blood Cancer 2008; 51: 303-304.
17.- Shimizu D, Nomura K, Matsuyama R, et al. Scrotal ulcers arising during treatment with all-trans retinoic acid for acute promyelocytic leukemia. Intern Med 2005;44:480-483.
CORRESPONDENCIA:
Beatriz Cuevas Ruiz.
Servcio de Hematología y Hemotarapia
Complejo Asistencial Universitario de Burgos.
E-mail: bcuevas @ hgy.es
Recibido, 15 de abril de 2011.
Publicado, 30 de abril de 2011