Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
REACCIONES ADVERSAS POR MEDICAMENTOS EN EMBARAZADAS, REPORTADAS AL SISTEMA DE FARMACOVIGILANCIA DE CUBA EN LOS AÑOS 2003 - 2007.
Juan Antonio Furones Mourelle1, Lisbet López Verde2, Giset Jiménez López3, Jenny Ávila Pérez4.
1Escuela nacional de Salud Publica de Cuba.
2Instituto de Ciencias Básicas y Preclínicas "Victoria de Girón".
3Unidad Coordinadora Nacional de Farmacovigilancia (UCNFv). Departamento de Farmacoepidemiología. Dirección de Medicamentos MINSAP.
4Facultad de Ciencias Médicas "Manuel Fajardo". Instituto Nacional de Oncología y Radiobiología.
La Habana. Cuba
furones @ infomed.sld.cu
Rev Electron Biomed / Electron J Biomed 2011;2:21-29.
Comentario del revisor Blanca de la Nogal Fernández. Hospital del Bierzo. Ponferrada. León. España
Comentario del revisor Martín de Frutos Herranz. Profesor de la Escuela Universitaria de Enfermería de la Universidad de Burgos. Burgos, España.
RESUMEN:
Se realizó un estudio observacional, descriptivo, transversal, que por la fuente de información es retrospectivo, para caracterizar las sospechas de reacciones adversas a medicamentos (RAM) en embarazadas, notificadas a la Unidad Coordinadora Nacional de Farmacovigilancia (UCNFv) en los años 2003 al 2007, basado en el método de notificación espontánea de sospecha de RAM. Fueron seleccionados la totalidad de los reportes en el periodo de estudio. Se identificaron los medicamentos que con mayor frecuencia provocaron RAM y se clasificaron de acuerdo a las categorías de riesgo en el embarazo. Las RAM fueron clasificadas también según severidad, causalidad y frecuencia. Se determinaron las RAM evitables y las causas de evitabilidad.
Los fármacos que con mayor frecuencia ocasionaron RAM fueron en primer lugar las tabletas de una combinación a dosis fija de fumarato ferroso, ácido fólico, ácido ascórbico y retinol, conocida como Prenatal®, que representó el 27.7% de las RAM y que no tiene establecido la categoría de riesgo en el embarazo, le siguieron el fumarato ferroso (6.9%)(categoría A), metronidazol (5.9%) (categoría B) y lidocaína hiperbárica (4.8%) (categoría B). En cuanto a severidad predominaron las RAM leves (65.9%), en la causalidad las probables (63.8%) y en la frecuencia de aparición, las frecuentes (66%). Las RAM evitables constituyeron un 8.3% y las causas principales de evitabilidad fueron las indicaciones y las dosis inadecuadas. Entre los medicamentos que más causaron efectos indeseables están los que no tienen clasificación de riesgo en el embarazo.
Las RAM en embarazadas se comportaron en cuanto a severidad y causalidad, de forma similar a las descritas en la población general de Cuba durante el período de estudio, no así para la frecuencia de aparición, ya que en el período de estudio a medida que pasaron los años, disminuyó el número de reportes de RAM de baja frecuencia de aparición en las embarazadas (de 39.2% en el 2003 a 29.6% en el 2007) y aumentó en la población general de Cuba (de 11.3% en el 2003 a 35.9% en el 2007). Una pequeña proporción de RAM fueron evitables, pero con grandes daños para la salud, ya que 2 ocasionaron muertes.
PALABRAS CLAVE: Embarazadas. Farmacovigilancia. Reacción adversa por medicamento.
SUMMARY: Our observational, descriptive, transversal and retrospective study was made to distinguish the suspicion of drugs adverse effects (DAE) during pregnancy that were notified to the National Coordinator Pharmacovigilance Unit. The study comprised since 2003 to 2007. It was based in the spontaneous notification method of suspicion of DAE. The complete reports of the choiced period of time were selected. The investigators identified the drugs more proclive to produce DAE. They were classified according to their pregnancy risk. The DAE were classified pursuant to severity, causality and frequency. It was also determined evitable DAE and avoidance´s causes.
Drugs that provoke DAE more frequently were Prenatal® (a combination of fixed doses of ferrous fumarate, folic acid, ascorbic acid and retinol) (27, 7%) (No pregnancy risk categorized), ferrous fumarate (6, 9%) (A category), metronidazol (5, 9%) (B category) and hyperbaric lidocaine (4.8%). Mild (65.9%), probable (63.8%) and frequently (66%) were the predominant DAE. The avoidable DAE constituted an 8, 3% and the main avoidance causes were unsuitable doses and indications. Drugs without pregnancy risk category were the drugs that provoked more DAE.
The severity and the causality were similar to those described in the general population of Cuba in the study´s period of time, except the frequency of the occurrence because low frequency DAE reports diminished in the progress of the years (from 39.2% in 2003 to 29.6% in 2007) although in the Cuban general population low frequency DAE reports increased (from 11.3% in 2003 to 35.9% in 2007). A small proportion of DAE were avoidable but they caused serious health damages to health, provoking two deaths.
KEYWORDS: Pregnant. Pharmacovigilance. Drug adverse effect.
INTRODUCCIÓN
En Cuba desde el año 1977 se están reportando efectos indeseables por medicamentos y desde 1994 se notifican al Sistema de Farmacovigilancia Internacional de la Organización Mundial de Salud. En 1996, esta actividad cobró un nuevo impulso con la creación de la red nacional de Farmacoepidemiología y la Unidad Coordinadora Nacional de Farmacovigilancia (UCNFv)1-6, que ha llevado a que se reporten por los profesionales sanitarios cubanos más de 28 000 notificaciones en el año 2000 y que en el año 2007 ocupara el lugar 13 a nivel mundial en la tasa de reporte de efectos indeseables por habitante7.
Cuando se obtiene la aprobación de comercialización de un fármaco, no significa que su administración esté exenta de riesgos por varios motivos. Esto tiene más importancia en las poblaciones especiales como las gestantes, los niños, los ancianos, pacientes con insuficiencia renal o hepática, que se excluyen de los ensayos clínicos, donde se verifica la eficacia y seguridad de los medicamentos. Por ello los efectos indeseables que se detectan en estas poblaciones de alta vulnerabilidad, tienen una marcada importancia clínica y salubrista. Sin embargo, no siempre se reportan todos los efectos indeseables que se producen en la práctica clínica habitual y no se caracterizan oportunamente los que se detectan8.
Las embarazadas son una subpoblación de gran interés para la Farmacovigilancia porque los medicamentos administrados a la madre pueden causar reacciones adversas en ella y en el niño. A pesar de esto, no siempre se cuenta con la información más actualizada sobre el riesgo de los fármacos en las embarazadas por falta de análisis de los datos disponibles.
El Sistema de Farmacovigilancia Cubano no está exento de la incidencia de reacciones adversas por medicamentos (RAM) en embarazadas y no cuenta con una descripción de las mismas desde su creación, por tanto se desconocen los medicamentos que las causan, el riesgo que estos representan para el feto, entre otros aspectos. Conscientes de esta necesidad, se decidió hacer un trabajo enmarcado dentro del campo de la farmacovigilancia, que aportara información al respecto, con el objetivo de describir las sospechas de RAM en embarazadas, notificadas a la Unidad Coordinadora Nacional de Farmacovigilancia (UCNFv) de Cuba en los años 2003 al 2007.
MATERIAL Y METODOS
Se realizó un estudio observacional, descriptivo, transversal, que por la fuente de información es retrospectivo y dentro del campo de la farmacovigilancia se corresponde con una serie de casos; para caracterizar las sospechas de RAM en embarazadas que fueron notificadas a la UCNFv en los años 2003 al 2007, basado en el método de notificación espontánea de sospecha de RAM. Se seleccionó la totalidad de los reportes de RAM por embarazada, por lo que trabajamos con el universo del periodo de estudio.
Utilizando la terminología establecida por la Organización Mundial de la Salud9, se identificaron las reacciones adversas, así como los principales fármacos que las causaron, esto último, teniendo en cuenta la clasificación que aparece en el Formulario Nacional de Medicamentos de Cuba (FNM de Cuba)10.Estos fármacos también fueron analizados teniendo en cuenta la categoría de riesgo en el embarazo, establecida por la Food and Drug Administration (FDA)9.
De acuerdo a la gravedad, las reacciones adversas se agruparon en leves, moderadas, graves y mortales. Este eje de clasificación analiza la necesidad de hospitalización o no, si la reacción o efecto indeseable requirió cambio de terapia o antídototerapia, si puso en peligro la vida, y/o si contribuyó directa o indirectamente a la muerte del paciente9.
Se determinó la frecuencia de aparición de la RAM según el FNM de Cuba10 y el British National Formulary11-12.
Al aplicar el algoritmo de Karch y Lasagna las RA, se agruparon en definitivas, probables, posibles, condicionales y no relacionadas. Este algoritmo de causalidad tiene en cuenta si existe o no una secuencia temporal plausible entre la administración del medicamento y la aparición de la supuesta reacción adversa, causas alternativas (otros fármacos, enfermedad de base) que pudieran explicar la reacción, si es una reacción conocida o no, respuesta al suspender el fármaco y si hubo reaparición de los síntomas tras la reexposición al mismo9.
Por último se clasificaron en evitables y no evitables, de acuerdo al cuestionario de Schumock GT, Thornton JP13. En este sentido se consideró que fue posible evitar la aparición de la RA cuando la prescripción (indicación, dosis y pauta terapéutica) fue incorrecta según el Formulario Nacional de Medicamentos10, en caso de automedicación, y/o cuando la acción farmacológica del medicamento podía explicar la reacción.
Análisis Estadístico.
Se aplicaron técnicas de estadística descriptiva para cada variable. Los principales resultados se presentaron en tablas y gráficos de distribución de frecuencias y de clasificación cruzada, para facilitar una mejor comprensión de los mismos. Las medidas de resumen utilizadas fueron la frecuencia relativa y la frecuencia absoluta.
RESULTADOS Y DISCUSIÓN
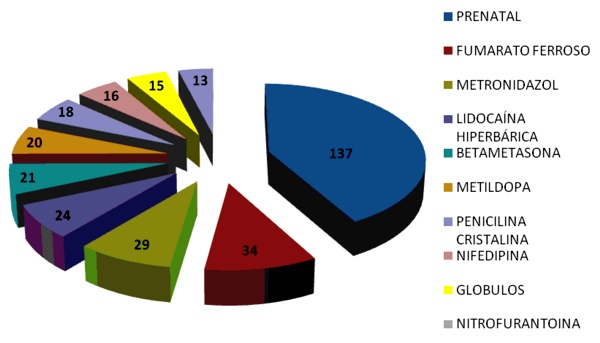
En el gráfico 1 se observa la distribución de los fármacos con mayor número de reportes de sospechas de reacciones adversas por medicamentos (RAM). Entre los 10 fármacos más notificados se encontró en primer lugar el Prenatal© -combinación a dosis fija de fumarato ferroso, ácido fólico, ácido ascórbico y retinol- con 137 (27.7%) seguido por el fumarato ferroso con 34 (6.9%), el metronidazol con 29 (5.9%), la lidocaína hiperbárica con 24 (4.8%), la betametasona con 21 (4.2%), metildopa con 20 (4.0%), penicilina cristalina con 18 (3.6%), nifedipina con 16 (3.2%), glóbulos o concetrados de hematíes con 15 (3.0%) y nitrofurantoína con 13 (2.6%).
Estos resultados se corresponden con los encontrados en un estudio de farmacovigilancia realizado en Pakistán en el año 200814. Consideramos que los resultados hallados están en correspondencia con los cambios fisiológicos que ocurren en el embarazo, en el que existe un aumento de la demanda de suplementos vitaminerales para el feto en formación, por lo que se le indican a la embarazada y además aumenta la predisposición de padecer infecciones genitourinarias, lo que lleva al aumento en la prescripción de antimicrobianos como el metronidazol y la nitrofurantoína.
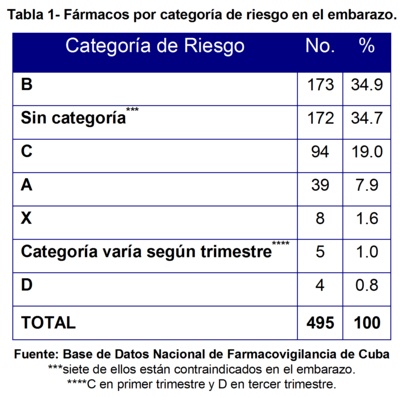
En la tabla 1 mostramos el número de fármacos causantes de RAM según las categorías de riesgo en el embarazo establecidas por la Food and Drog Administration (FDA). Tenemos que los fármacos correspondientes a la categoría B fueron los que mayor número de RAM ocasionaron con 173 notificaciones para un 34.9%, entre ellos se pueden citar el metronidazol, la lidocaína hiperbárica, penicilina cristalina, nitrofurantoína y otros.
Le siguieron los fármacos sin categoría, con 172 reportes para un 34.7% entre los que encontramos las tabletas de Prenatal® -combinación a dosis fija de fumarato ferroso, ácido fólico, ácido ascórbico y retinol- , los glóbulos o concentrado de hematíes y otros que a pesar de no estar clasificados entre las categorías de riesgo en el embarazo están contraindicados, como el Espasmoforte® (compuesto por metamizol y camilofilina), el Dextran 40® y algunos anticonceptivos hormonales como el Triquilar® o Trienor® -que está formado por levonorgestrel y etinilestradiol- y el Noristerat® (enantato de noretisterona).
A continuación la categoría C con 94 para un 19.0%, aquí se encontraron la betametasona, metildopa, nifedipino. Luego la categoría A con 39 para un 7.9%, entre los que se destacó el fumarato ferroso. En la categoría X se encontraron 8 para un 1.6%, aquí los fármacos que ocasionaron las RAM fueron la oxitocina y el metotrexate, este último indicado en 3 casos de embarazo molar. Encontramos 5 reportes (1.0%) de RAM correspondientes a la dipirona (metamizol sódico), cuya categoría varía según el trimestre de la gestación, considerándose categoría C cuando se administra en el primer trimestre y en la D cuando se administra en el tercer trimestre. Por último la categoría D con 4 para un 0.8%, donde se reportó el ácido acetilsalicílico.
Al comparar estos resultados con un estudio de farmacovigilancia realizado en Addis Ababa, Etiopía15, publicado en enero de 2009, encontramos que nuestros resultados difieren, ya que su mayor frecuencia de exposición fue a los fármacos pertenecientes a la categoría de riesgo A, siguiendo la B, C, D y por último la X, orden que no se cumplió en el nuestro.
Si tenemos en cuenta que el Prenatal® no tiene clasificación de riesgo en el Formulario Nacional de Medicamentos (FMN) de Cuba y que está constituido por retinol 2000 UI, fumarato ferroso 100 mg, ácido fólico 0.25 mg y ácido ascórbico 150 mg, a dosis fijas; los resultados obtenidos se verían afectados, ya que en el compuesto hay tres fármacos que pertenecen a la categoría de riesgo A (retinol, dosis menor de 2500 UI, fumarato ferroso y ácido fólico, dosis menor de 0.8 mg) y uno a la C (ácido ascórbico).
Con este punto de vista se incrementaría el número de medicamentos causantes de RAM correspondientes a las categorías A y C. Es por esto que recomendamos establecer por un grupo de expertos la categoría de riesgo en el embarazo del Prenatal® y que se refleje en el FNM de Cuba, ya que al no estar clasificado aumenta la inseguridad de su uso.
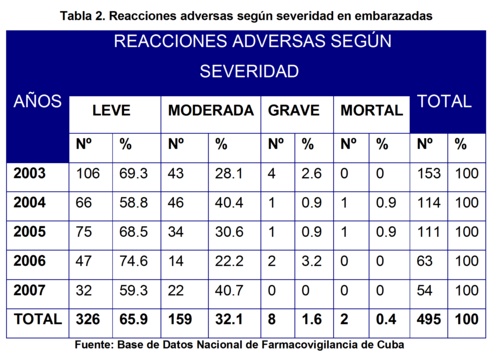
En la tabla 2 se puede apreciar la distribución de las sospechas de RAM según el grado de severidad. Hubo un predominio de las reacciones adversas leves que fueron 326 para un 65.9%, seguido de las moderadas con 159 para un 32.1%, luego las graves con 8 para un 1.6% y por último las mortales que fueron 2 para un 0.4%. Estos resultados se corresponden con los obtenidos en los informes anuales de la UCNFv en los años 200316, 200517, 200618y 200719 en los que predominaron las reacciones adversas leves sobre las moderadas, graves y mortales. No encontramos estudios que abordaran las RAM según este eje de clasificación en embarazadas.
Si tenemos en cuenta que los sistemas de farmacovigilancia están diseñados para captar las RAM mortales, graves y moderadas, que son las que generalmente no aparecen en los ensayos clínicos controlados previos a la comercialización de los fármacos, en los que por cuestiones éticas las embarazadas no son incluidas; entonces consideramos pertinente que debe mejorarse la calidad en las notificaciones para detectar estos tipos de RAM, mediante diferentes intervenciones como la educativa y gerencial.
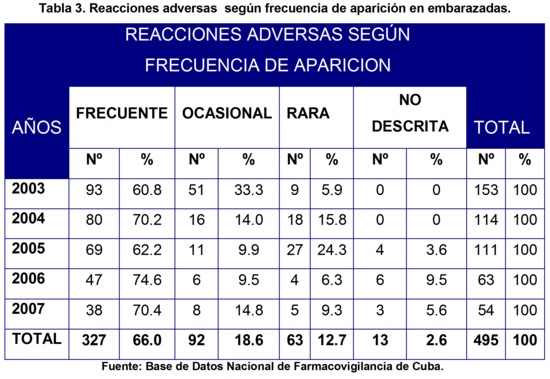
En la tabla 3 se muestran las RAM en cuanto a la frecuencia de aparición. Las reacciones adversas que predominaron en los reportes de sospecha de RAM fueron las frecuentes con 93 en el año 2003, 80 en el 2004, 69 en el 2005, 47 en el 2006 y 38 en el 2007. Al analizar el total de RAM de baja frecuencia de aparición por año tenemos que fueron 60 en el año 2003, 34 en el 2004, 42 en el 2005, 16 en el 2006 y 16 en el 2007. Es decir, que disminuyeron con el transcurso de los años. Merece resaltar 13 RAM no descritas en el FNM de Cuba en esta población especial.
Al comparar estos resultados con los reportados en los informes anuales de la UCNFv16-20, correspondientes al período de estudio, obtuvimos que no fueron similares en cuanto a reportes de RAM de baja frecuencia, ya que en la población general, el número de reportes de baja frecuencia de aparición fue aumentando (de 1428 en el año 2003 a 2953 en el año 2007), lo que habla a favor de un incremento en la calidad del sistema de farmacovigilancia, no ocurriendo así en los referentes a las embarazadas.
Consideramos que debe mejorarse la calidad de los reportes en esta población especial, para ello se necesita una buena formación de los médicos y enfermeras ginecobstetras, de los especialistas en Medicina General Integral (MGI) y de todo el personal de salud relacionado con las embarazadas, en los temas de farmacoepidemiología y farmacovigilancia.
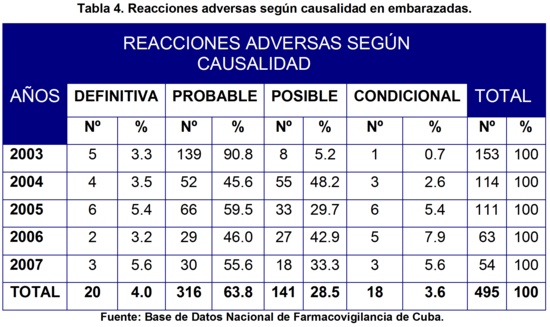
Al analizar en la tabla 4 la distribución de las RAM según causalidad, observamos que predominaron las reacciones adversas probables con 316 reportes para un 63.8%, luego las posibles con 141 (28.5%), después las definitivas con 20 (4.0%) y por último las condicionales con 18 (3.6%). No se encontró reacciones adversas no relacionadas. En los informes anuales de la UCNFv, correspondientes a los años en estudio16-20, también predominaron las reacciones adversas probables y posibles.
Estos resultados son alentadores, ya que son indicadores de una buena calidad en los reportes, así como que haya pocas notificaciones condicionales y que no existan las no relacionadas. Hay que resaltar como positivo, que las definitivas ocupen los últimos lugares, pues tienen como limitante la reexposición del paciente al efecto adverso provocado por el fármaco, lo que ocurre infrecuentemente y eticamente no es correcto
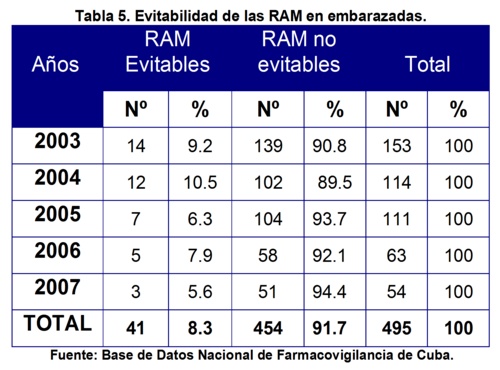
Con respecto a la clasificación según la evitabilidad o no de las RAM se encontró que sólo 41 de ellas se evaluaron como evitables para un 8.3% y las 454 restantes fueron no evitables para un 91.7% (tabla 5). No obstante, entre las evitables 2 fueron mortales. Una ocurrida en octubre del 2005 por la automedicación de 1 tableta (500 mg) de paracetamol por cefalea en una paciente de 18 años, con 27,4 semanas de gestación, sin antecedentes de enfermedad, que ocasionó incontinencia urinaria como reacción principal y además vómitos.
Esta reacción no se encuentra descrita en la literatura y a pesar de que se le realizó autopsia a la paciente no se encontró otra explicación a la muerte, por lo que se clasificó como condicional de acuerdo a la causalidad. En este caso la causa de evitabilidad fue la automedicación de acuerdo al algoritmo de Schumock y Thornton.
La otra ocurrió en marzo del 2004 por la administración de 1 frasco (500 mL) de Dextran 40® (10%) para tratar hipotensión, además de 1 ampolla(10 mg=2 mL) de diazepam, ocasionando shock anafiláctico que llevó a un paro cardiorrespiratorio como reacción principal. En este caso la causa de evitabilidad fue indicación inadecuada, ya que el Dextrán-40 está contraindicado en el embarazo.
Las causas de evitabilidad se muestran en la tabla 6. Por indicación inadecuada resultaron 26 reportes para un 63.4%, por dosis inadecuada 13 (31.7%), por dosis, intervalo y duración inadecuados 1 (2.4%), y por automedicación 1 (2.4%).

Al comparar estos resultados con un estudio nacional21, los resultados no coincidieron. No hemos encontrado trabajos que aborden el análisis de la evitabilidad de las RAM en embarazadas.
Los datos obtenidos ponen de manifiesto como la prescripción inadecuada puede causar daños a la salud tan graves como la muerte del paciente, lo que puede evitarse con el perfeccionamiento de nuestro personal sanitario, exigiendo y brindando herramientas para su preparación, así como insistiendo en la no automedicación.
CONCLUSIONES
Los medicamentos que con mayor frecuencia se reportaron causantes de reacción adversa fueron Prenatal® -combinación a dosis fija de fumarato ferroso, ácido fólico, ácido ascórbico y retinol-, fumarato ferroso, metronidazol y lidocaína hiperbárica.
De todos ellos los de mayor número de reportes de sospechas de RAM no tienen clasificación de riesgo en el embarazo, lo que incrementa la inseguridad de su uso.
Las RAM en embarazadas se comportaron en cuanto a severidad y causalidad de forma similar a como se describieron en la población general de Cuba, no siendo así respecto a la frecuencia.
Una pequeña proporción de RAM fue evitable pero con grandes daños para la salud, ya que 2 ocasionaron muertes, siendo las principales causas de evitabilidad las indicaciones y dosis inadecuadas.
RECOMENDACIONES
Debe establecerse por un grupo de expertos la categoría de riesgo en el embarazo del medicamento Prenatal® - combinación a dosis fija de fumarato ferroso, ácido fólico, ácido ascórbico y retinol- por ser el de mayor número de reportes, y que se refleje en el FNM de Cuba.
Consideramos que sería oportuno diseñar y aplicar una intervención formativa-informativa sobre farmacovigilancia y el uso adecuado de los medicamentos en esta población con características especiales, así como que sería muy útil desarrollar estudios que identifiquen señales de alerta de RAM en embarazadas, aplicando métodos de avanzada (Reporting Odd Ratio, Proportional Reporting Ratio).
REFERENCIAS
-
1.- Debesa F, Jiménez G, Pérez J. Vigilancia farmacológica en Cuba. Situación actual. Bol Fármacos 2001; 4(1).
Disponible en: http://www.boletinfarmacos.org/Download/feb01.pdf
2.- Debesa F, Jiménez G, Pérez J, Avila J. La estrategia de Farmacoepidemiología en Cuba. Características y papel de la Unidad Coordinadora de Farmacovigilancia en Cuba. Bol Fármacos. 2001; 4(2). Disponible en: http://www.boletinfarmacos.org/Download/abr01.pdf
3.- Debesa F, Jiménez G, Bastanzuri T, Avila J, Rosell A, Portuondo C, Yera I. La Unidad Coordinadora Nacional de Farmacovigilancia, principales funciones y resultados. Rev Cubana de Farm. 2002; 36 (Suplemento Especial N°. 2):214.
4.- Página Web del Centro para el Desarrollo de la Farmacoepidemiología. Boletines de Farmacovigilancia. Disponible en: http://www.cdf.sld.cu
5.- Jiménez G,Debesa F, González B, Ávila J, Pérez J. El Sistema Cubano de Farmacovigilancia, seis años de experiencia en la detección de efectos adversos. Rev Cubana Farm 2006;40:1.
6.- Debesa F, LLovet S. La Farmacovigilancia, una reflexión 23 años después. Resumed 2000; 13(5):216-224.
7.- Debesa F, Jiménez G, Figueras A, Diógenes E, Pérez J, Avila J, Laporte JR. Spontaneous reporting of adverse drug reactions in Cuba: integrating continuous education, training and research in a network approach. Br J ClinPharmacol. 2002; 54:333-336.
8.- Zapata Martínez A. Farmacovigilancia. En: Morón - Levy N, ed. Farmacología General. Ed. La Habana: ECIMED, 2002: 139-146.
9.- Anónimo. Terminología de las reacciones adversas de la OMS. The Uppsala Monitoring Centre. 2008.
10.- Ministerio de Salud Pública. Centro para el Desarrollo de Farmacoepidemiología en Cuba. Formulario Nacional de Medicamentos. La Habana: ECIMED, 2006.
11.- British National Formulary. 51th. Edition. 2006 [fecha de acceso noviembre 2009]; URL disponible: http://www.bnf.org/bnf/bnf/current/3705.htm
12.- Jiménez G, Debesa F, González B, Ávila J, Bastansuri T, Pérez J. Normas y procedimientos de trabajo del Sistema Cubano de Farmacovigilancia. Unidad Coordinadora Nacional de Farmacovigilancia. 2006.
13.- Schumock GT, Thornton JP. Focusing on preventability of adverse drug reactions. Hosp Pharm 1992; 27:538.
14.- Rohra DK, Das N, Azam SI, Solangi NA, Memon Z, Shaikh AM, Khan NH. Drug-prescribing patterns during pregnancy in the tertiary care hospitals of Pakistan: a cross sectional study. BMC PregnancyChildbirth. 2008 Jul 15; 8:24. Disponible en: http://www.biomedcentral.com/1471-2393/8/24/abstract
15.- Binyam K, Teferi G and Ashebir G. Assessment of drug use among pregnant women in Addis Ababa, Ethiopiay. Pharmacoepidemiology and drug safety 2009; 18: 462-468. Disponible en: http://www.interscience.wiley.com
16.- Unidad Coordinadora Nacional de Farmacovigilancia. Informe Anual, 2003: Centro para el Desarrollo de la Farmacoepidemiologia en Cuba; 2003. Disponible en: http://www.cdf.sld.cu./fv/Informes%20anuales/InfAnual2003.doc
17.- Unidad Coordinadora Nacional de Farmacovigilancia. Informe Anual, 2005: Centro para el Desarrollo de la Farmacoepidemiologia en Cuba; 2005. Disponible en: http://www.cdf.sld.cu./fv/Informes%20anuales/InfAnual2005.doc
18.- Unidad Coordinadora Nacional de Farmacovigilancia. Informe Anual, 2006: Centro para el Desarrollo de la Farmacoepidemiologia en Cuba; 2006. Disponible en: http://www.cdf.sld.cu./fv/Informes%20anuales/InfAnual2006.doc
19.- Unidad Coordinadora Nacional de Farmacovigilancia. Informe Anual, 2007: Centro para el Desarrollo de la Farmacoepidemiologia en Cuba; 2007. Disponible en: http://www.cdf.sld.cu./fv/Informes%20anuales/InfAnual2007.doc
20.- Unidad Coordinadora Nacional de Farmacovigilancia. Informe Anual, 2004: Centro para el Desarrollo de la Farmacoepidemiologia en Cuba; 2004. Disponible en: http://www.cdf.sld.cu./fv/Informes%20anuales/InfAnual2004.doc
21.- Jiménez G, Lara MC, Bayare H, Rego J, García B. Costo de los efectos adversos que causan ingreso en hospitales seleccionados de ciudad de la Habana. Año 2006. Boletín Fármacos. 2009 Abr.; 12(2).
CORRESPONDENCIA:
Dª Lisbet López Verde
Instituto de Ciencias Básicas y Preclínicas "Victoria de Girón".
La Habana, Cuba.
Mail: luis.perez @ infomed.sld.cu
Desde los efectos devastadores de la talidomida en los últimos años de la década de los 50 y principios de los 60, se puso de relieve la suma importancia de la Farmacovigilancia así como del uso de medicamentos en el periodo del embarazo y la lactancia. Entre los medicamentos pertenecientes a la categoría X de la FDA se encuentran: Misoprostol, todos los inhibidores de la HMG CoA reductasa (lovastatina, fluvastatina, pravastatina, simvastatina, atorvastatina), isotretionina, anticonceptivos hormonales, metotrexato, medroxiprogesterona, leuprorelina, goserelina, algunas benzodiazepinas como triazolam, flurazepam, nicotina en chicles, efavirenz, ribavirina.
Antibióticos considerados categoría D son: Voriconazol, Quinina, Doxiciclina, Clortetraciclina, Estreptomicina, Kanamicina, metronidazol en el primer trimestre de embarazo. Entre los medicamentos considerados seguros se encuentran: paracetamol, labetalol, metildopa, lidocaína, penicilinas, macrolidos, heparinas, Cariban© (doxilamina y piridoxina), zidovudina, insulina
Para terminar recalcar la necesidad y la obligación por parte del personal sanitario de la notificación de sospechas de reacciones adversas asociadas a medicamentos al sistema de Farmacovigilancia del país donde se trabaja, como el artículo que presentamos que describe la situación en Cuba, para valorar la verdadera frecuencia con la que ocurren estas reacciones (sobre todo en poblaciones especiales como niños, ancianos, mujeres embarazadas o en periodo de lactancia…), investigar las posibles causas y buscar soluciones.
Bibliografía recomendada disponible en Internet:
Comentario del revisor Dª Blanca de la Nogal Fernández. Hospital del Bierzo. Ponferrada. León. España
Pérez-Landeiro A, Allende-Bandrés MA y col. Teratogénesis: clasificaciones. Farm Hosp 2002; 26(3): 171-177.
Gesida. (Grupo de estudio del Sida).
Vallano A, Arnau JM. Antimicrobianos y embarazo. Enferm. Infecc Microbiolo Clin 2009; 27(9): 536-542.
Sociedad española de farmacia hospitalaria. Dispone de un buscador en la parte superior derecha de la pagina web
Fichas técnicas de medicamentos comercializados en España:
Fisterra: directorio de guias clínicas en español (medicina basada en la evidencia); selección de Ginecología
Portal del servicio navarro de salud.
Sistema español de farmacovigilancia
