Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
NEUROCISTICERCOSIS PARENQUIMATOSA EN FORMA DE QUISTES DEGENERATIVOS. CASO CLÍNICO.
Marcos D. Iraola Ferrera, Frank C. Álvarez Lib,
Marcos A. Iraola Luquesc, Yaimet Casas Carbonellc
aUnidad de Cuidados Intensivos. Hospital Universitario Dr. Gustavo Aldereguía Lima. Cienfuegos. Cuba
bUnidad de Cuidados Intensivos. Clínica Meditex. Luanda, Angola.
cHospital Universitario "Celestino Hernández Robau". Instituto Superior de Ciencias Médicas "Serafín Ruiz de Zarate".
Santa Clara. Villa Clara. Cuba.
marcos.iraola @ gal.sld.cu
Rev Electron Biomed / Electron J Biomed 2012;2:46-53
RESUMEN:
La neurocisticercosis, la parasitosis más frecuente del sistema nervioso central, consiste en la localización de la forma larvaria de la Taenia solium en el neuroeje propiamente tal o en los compartimientos ventrículo-meníngeo del sistema nervioso central. En la actualidad representa un serio problema de salud pública. Varios síndromes anatomoclínicos de la neurocisticercosis han sido descritos.
Se presenta un caso con neurocisticercosis parenquimatosa moderada en forma de quistes degenerativos donde la cefalea fue el síntoma predominante lo que motivo varias evaluaciones sin obtenerse un diagnóstico definitivo. Pasado un año se realizó TC de cráneo simple y contrastada donde aparecieron lesiones sugestivas de neurocisticercosis parenquimatosa, se impuso tratamiento con prazicuantel y prednisona sin obtener mejoría clínica y tomográfica lo que motivó su ingreso, iniciándose entonces tratamiento con albendazol y dexametasona obteniéndose en esta ocasión mejoría, tanto clínica como tomográfica. Durante el seguimiento ambulatorio después del alta la paciente se mantuvo asintomática.
PALABRAS CLAVES:Helmintiasis del sistema nerviosos central, Neurocisticercosis, diagnóstico, tratamiento.
SUMMARY:
Neurocysticercosis is the most frequent parasitism in the central nervous system. It consists on the localization of the larval form of the Taenia solium in the neuraxis or in the meningeal- ventricular compartment of the central nervous system. At present it represents a serious health problem. Several anatomoclinical syndromes of neurocysticercosis have been described.
A case of mild parenchymal neurocysticercosis in degenerating cyst form where cephalalgia was the predominant symptom resulted into several evaluations without any definite diagnosis. After a year, a simple and contrastive skull CT scan was performed on the patient. Suggested lesions of parenchymal neurocysticercosis appeared. A treatment with praziquantel and prednisone was given to the patient without any clinical and tomographic improvement on the patient. This brought about the admission of the patient into the hospital. A treatment with dexamethasone and albendazole began. As a result of this treatment, the patient began to improve her clinical and tomographic condition. During the patient's follow up, she continued asymptomatic.
KEYWORDS: Central nervous system helminthiasis, Neurocysticercosis, diagnosis, drug therapy (MeSH)
INTRODUCCIÓN
La neurocistecercosis es una infección provocada por larvas de Taenia solium (TS) que se produce cuando el hombre se convierte accidentalmente en el huésped intermediario de dicho estado. Cuando los cisticercos invaden el sistema nervioso condicionan una enfermedad pleomórfica denominada neurocistecercosis (NCC). La cisticercosis es la enfermedad parasitaria más frecuente del sistema nervioso central (SNC), y en la actualidad representa en serio problema de salud pública, no solo en países en desarrollo de América Latina, África y Asia, sino también en los Estados Unidos de América y en algunas naciones europeas que han experimentado recientemente un movimiento migracional masivo de personas provenientes de áreas endémicas, debido a su alta frecuencia, al elevado costo de su diagnóstico (atención médica, estudios tomográficos, estudios serológicos), al elevado costo de su tratamiento médico (recordemos que la población blanco de esta enfermedad es aquella que tiene menores recursos económicos) y al daño que determina en el cerebro (ya sea en su etapa viable o calcificada) de esta manera representa un desafío a los políticos de salud pública del país pero cuando estas políticas son avasalladas o inexistentes entonces representan un desafío a los médicos en su diagnóstico, tratamiento y el manejo de las complicaciones neurológicas1-2.
El hombre es el único huésped definitivo de la TS, mientras que tanto el cerdo como el hombre pueden ser huéspedes intermediarios. Este estado esta compuesto por un escólex y un cuerpo con cientos de proglótides. La tenia habita en el intestino del hombre, donde se adhiere a su pared mediante el escólex. Cada día algunos proglótides cargados con miles de huevecillos se separan de su extremo distal y son expulsados con las heces. En lugares con inadecuada eliminación de excretas los cerdos ingieren huevos de TS junto con las heces. Una vez ingeridos, los huevecillos se transforman en oncosferas, que atraviesan el intestino, entran a la circulación y se alojan en los tejidos del cerdo, donde se transforman en larvas (cisticercos). Cuando el hombre ingiere carne de cerdo mal cocinada y contaminada con cisticercos las larvas se evaginan, el escólex se adhiere a la pared intestinal y el parásito comienza a formar proglótides. El hombre desarrolla la cistercosis cuando se convierte en huésped intermediario de la TS al ingerir sus huevecillos. El mecanismo por el cual los huevecillos entran al torrente sanguíneo y son distribuidos a los tejidos del hombre es similar al descrito en los cerdos. La principal forma de contagio humano es la contaminación oral-fecal a partir de individuos portadores de TS, los que pueden autoinfestarse o infestar a otras personas, sobre todos a sus contactos domésticos1-3.
Cuando los cisticercos entran en el sistema nervioso se encuentran en estado vesicular en el que son viables y desencadenan mínimos cambios inflamatorios en el tejido cerebral adyacente. Los cisticercos pueden permanecer durante décadas en este estado o entrar, como resultado de un ataque inmunológico del huésped, en un proceso degenerativo que termina con su destrucción. Los estadios por los que atraviesan los cisticercos hasta su destrucción comprenden, estadio coloidal, estadio granular y estadio calcificado. Cada uno de estos estadios se caracteriza por cambios en el tejido cerebral vecino y por alteraciones específicas de neuroimagen (Tabla 1)1-3.
Las características de la NCC en Angola son pocos conocidas, al menos nosotros no encontramos ningún artículo publicado en revistas indexadas. Presentamos un caso de NCC parenquimatosa donde el síntoma de presentación y el más relevante fue la cefalea lo que motivó la demora de un año para realizarse el diagnóstico.
CASO CLÍNICO.
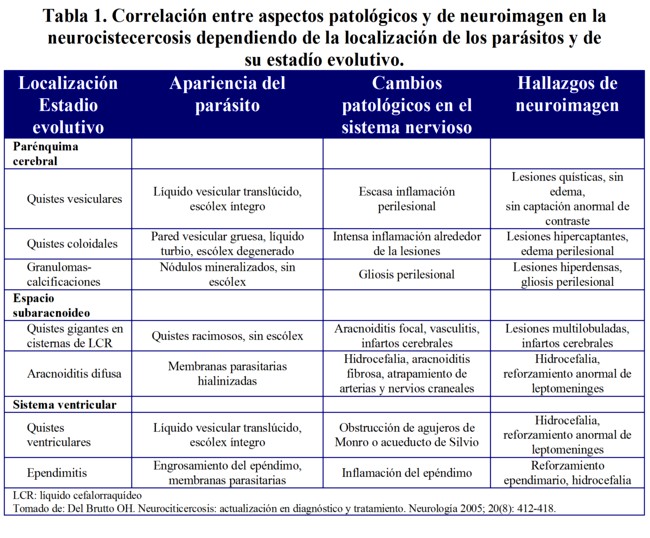
Paciente mujer de 23 años de edad, de nacionalidad angoleña, que desde hacia un año antes comenzó a padecer de cefalea de localización variable, a la cual se le atribuyeron diferentes diagnósticos por varias especialidades a las que acudió, llevando diversos tratamientos (antimigrañosos, antiinflamatorios no esteroideos, analgésicos y sedantes, entre otros) sin obtener alivio. Ante la persistencia de la cefalea se realizó tomografía computarizada (TC) de cráneo, simple y contrastada, constatándose lesiones sugestivas de NCC parenquimatosa (Figura 1), se impone tratamiento con prazicuantel (50 mg/Kg/día por 15 días) y prednisona (1 mg/Kg/día).
Lesiones redondeadas hipodensas en región temporal, parietal izquierda, frontal posterior y occipital derecha
sin evidencia de desviación de las estructuras de la línea media. Después de inyección de
contrate intravenoso se evidencia captación periférica.
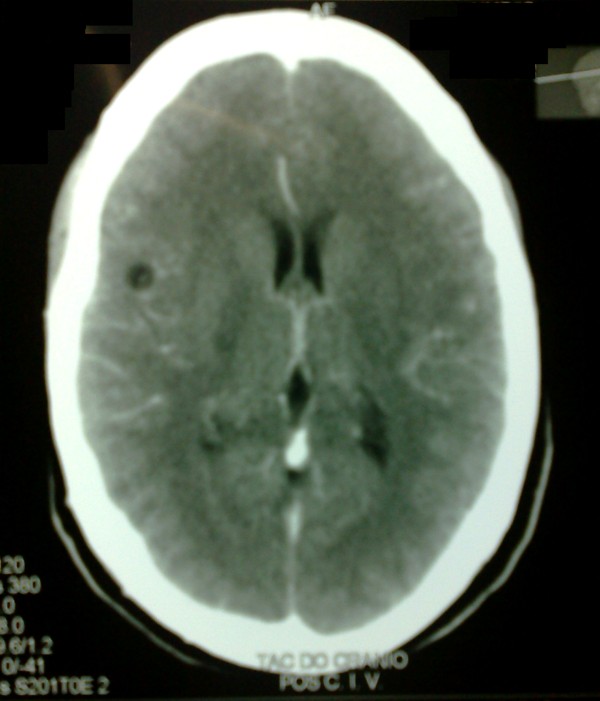
Evolutivamente, a los 30 días de concluido el tratamiento, persistía la cefalea, apareció sensación de atontamiento y lentitud del pensamiento, así como empeoramiento de las imágenes tomográficas (Figura 2). Lo que motivó su hospitalización. No se encontraron anormalidades en el examen físico ni en los exámenes de laboratorio realizados.
Lesiones redondeadas hipodensas que captan contraste en forma de anillo en región occipital derecha.
Hay otras dos lesiones en región parietal izquierda con edema perilesional sin evidencia de desviaciones de la estructuras de la línea media.
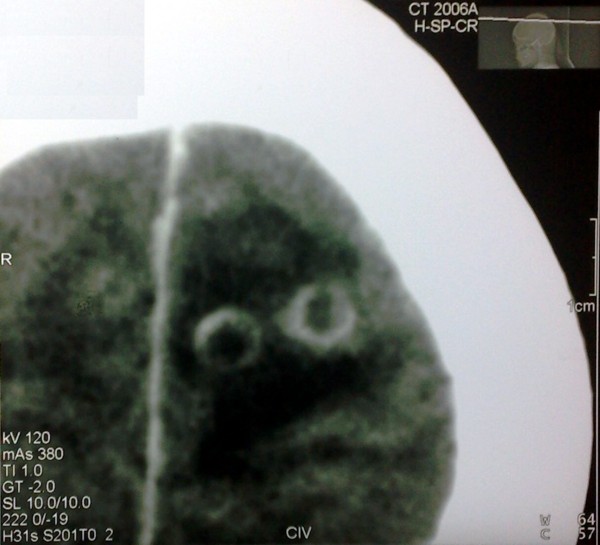
Se inicio tratamiento con anticonvulsivante (difenilhidantoina) y esteroides (dexametasona, 12 mg/día con pauta descendente) y cisticida (albendazol, 15 mg/Kg/día por una semana) observándose mejoría progresiva de los síntomas hasta su desaparición en el momento del alta. En la evaluación realizada, posteriormente al alta, la paciente se encontraba libre de síntomas y con mejoría de las imágenes tomográficas (Figura 3).
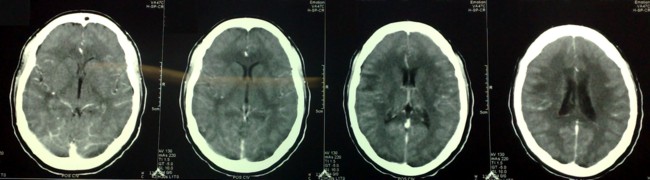
Figura 3. TC de cráneo, simple y contrastada.
Comparativamente con las imágenes anteriores atribuibles a NCC se identifican signos de mejoría.
DISCUSIÓN
La NCC es una enfermedad pleomórfica debido a diferencias individuales en el número y localización de las lesiones, así como en la gravedad de la respuesta inmunitaria del huésped frente al parasito. Muchos casos pueden ser asintomáticos, un estudio en una población rural de México encontró una prevalencia de NCC del 9.1%, los cuales fueron asintomáticos y solo mostraban lesiones calcificadas4. En las series de pacientes sintomáticos la epilepsia es la manifestación más frecuente de la NCC, observándose en más del 70% de los casos. En regiones endémicas la presencia de epilepsia de inicio tardío es altamente sugestiva de NCC5-6.
En nuestra paciente la manifestación clínica de presentación y predominante fue la cefalea, la que motivó el retardo de un año para llegar al diagnóstico. En algunos estudios ocupa el segundo lugar entre las manifestaciones clínicas más frecuentes, variando entre el 4.6% y el 61.5%,7 en otros, con un menor número de pacientes incluidos, ocupa la primera posición8.
Cuando la cefalea se presenta acompañando a otras manifestaciones clínicas, por ejemplo, epilepsia o signos de focalización neurológica, permite acelerar el proceso del diagnóstico; sin embargo, cuando se presenta sola este proceso puede ser lento, si a esto se añade el contexto donde se produce, población con escasos recursos económicos y, por tanto, difícil acceso a los estudios diagnósticos se puede afirmar que se convierte en un reto para los médicos, en ocasiones insuperable. Aunque la mayoría de los pacientes tienen un examen neurológico normal se han descrito una variedad de signos focales que resultan de las diferentes localizaciones, incluyendo déficit motor, ataxia cerebelosa, disfunción del tronco y movimientos involuntarios anormales9.
Para el diagnóstico correcto de NCC es necesaria una interpretación adecuada de los hallazgos clínicos, de neuroimagen y serológicos y, sobre todo, epidemiológicos (Tabla 2).

Los hallazgos de neuroimagen en la NCC parenquimatosa dependen de la viabilidad de los cisticercos. De estos hallazgos los más característicos son las calcificaciones y las lesiones quísticas en los que es posible identificar el escólex en su interior. Con excepción de las lesiones quísticas, otros hallazgos que pueden observarse no son específicos y pueden ser vistos en otro tipo de infección del sistema nervioso1,10-11.
El diagnóstico de nuestra paciente fue clasificado, según los grados de certeza, como definitivo por los argumentos que aparecen en la Tabla 3.

El ELISA y el Inmunoblot son pruebas destinadas a la detección de anticuerpos anticisticerco en sangre y líquido cefalorraquídeo1, estos deben ser utilizados como complemento de los estudios de neuroimagen, pero nunca deben, en forma aislada, confirmar o excluir el diagnóstico de NCC. Los pacientes con cisticercos musculares o teniasis presentan resultados positivos, sin que eso signifique que tengan una NCC. Por otra parte, pacientes con NCC calcificada o con lesiones cerebrales únicas pueden cursar con pruebas inmunológicas negativas12. En nuestro caso no tuvimos acceso para la realización de estas pruebas.
El tratamiento de la NCC no es estándar debido a la variedad de presentación de esta enfermedad. Aquí solo comentaremos el tratamiento de la NCC parequimatosa, aunque en la Tabla 4 aparece el tratamiento de todas la variedades1.
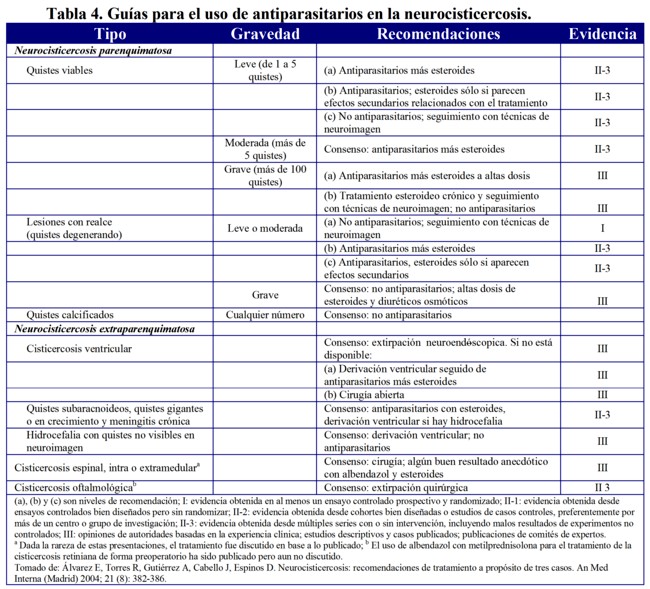
Los pacientes con NCC parenquimatosa y calcificaciones no deben recibir tratamiento cisticida. Cuando estos se presentan con crisis convulsivas es necesario el uso de fármacos antiepilépticos. Los pacientes con quistes viables deben recibir tratamiento cisticida. Si bien algunos autores han sugerido que el prazicuantel o el albendazol no modifican la historia natural de la enfermedad, la mayoría de estudios aleatorizados que han comparado la efectividad del tratamiento cisticida frente a placebo o sin tratamiento han demostrado la utilidad de estos fármacos, tanto en pacientes con lesiones anulares hipercaptantes como en aquellos con lesiones quísticas, siendo el efecto mucho más evidente en estos últimos.
El prazicuantel condiciona la desaparición del 60 a 70% de los cisticercos parenquimatosos tras 15 días de tratamiento a dosis de 50 mg/Kg/día. Se ha sugerido que el tratamiento con prazicuantel puede acortarse a un solo día, siempre y cuando se utilicen dosis de 75 a 100 mg/Kg y que el tiempo entre dosis se acorte a dos horas, este esquema parece ser de mayor utilidad en pacientes con quistes únicos. El albendazol inicialmente se utilizó en dosis de 15 mg/Kg/día durante 30 días; sin embargo, estudios posteriores demostraron que el tratamiento podía ser reducido a una semana con iguales resultados. El albendazol destruye el 80% de los cisticercos parenquimatosos y ha demostrado ser superior al prazicuantel en diversos estudios comparativos, no solamente por su mejor porcentaje de destrucción de quistes, sino por su menor coste. Si bien los primeros estudios de tratamiento de la NCC fueron destinados a documentar la destrucción de quistes en TC, estudios posteriores han demostrado que el uso de fármacos cisticidas también mejora el curso clínico de los enfermos, reduciendo significativamente el riesgo de crisis convulsivas durante el seguimiento.
Los corticoides han sido asociados a los cisticidas con el objetivo de disminuir la reacción inflamatoria que resulta de la destrucción de los quistes y que podría afectar la pared de los vasos con el consiguiente riesgo de infarto13. Las dosis recomendadas son: dexametasona 6-12 mg/día,13 prednisona 1 mg/Kg/día y betametasona 12-16 mg/día dividida en dos o tres subdosis14. Debe tenerse en cuenta que la dexametasona puede aumentar los niveles de albendazol en plasma y disminuir los de prazicuantel. Para obtener mayores niveles plasmáticos de albendazol se ha utilizado cimetidina en dosis de 400 mg dos veces al día.
En resumen podemos decir que la NCC debe ser tenida en cuenta en el diagnóstico diferencial de la cefalea cuando esta se presenta en como único síntoma en un área endémica como lo es la República de Angola.
REFERENCIAS
1.- Del Brutto OH. Neurociticercosis: actualización en diagnóstico y tratamiento. Neurología 2005; 20(8): 412-418.
2.- Duran JC. Neurocisticercosis. Problemas comunes. Rev Neurol Clin 2004; 2(1): 52-55.
3.- Del Brutto OH, Sotelo J. Etiopatogenia de la neurocisticercosis. Rev Ecuat Neurol 1993; 2: 22-32.
4.- Fleury A, Gómez T, Álvarez I, Meza D, Huerta M, Chavarría A, et al. High prevalence of calcified silent neurocysticercosis in a rural village of México. Neuroepidemiology 2003; 22: 139-45.
5.- Garcia HH, Gilman R, Martinez M, Tsang VC, Pilcher JB, Herrera, et al. Cysticercosis as a major cause of epilepsy in Peru. The Cysticercosis Working Group in Peru. Lancet 1993; 341: 197-200.
6.- Golfo AL, Guillen D, Campos P, Burneo JC. Cisticercosis as the main cause of partial seizures in children in Peru. Rev Neurol 2004; 39: 924-926.
7.- Doder R, Madle-Samardzija N, Canok G, Vukadinov J, Tukulov V. Neurocysticercosis 5 years` experience at the Clinic for Infections Diseases. Med Pregd 2002; 55(11-12): 523-7.
8.- Villalobos R. Manifestaciones clínicas de presentación de neurocistecercosis. Kasmera 2003; 31(2): 80-85.
9.- San Juan D. Manifestaciones clínicas de la neurocisticercosis. Neurología 2009; 24(15): 331-335.
10.- Coyle CM, Tanowitz HB. Diagnosis and treatment of neurocysticercosis. Interdisc Perspect Infect Diseases 2009, Article ID 180742, 9 pages, doi:10.1155/2009/180742.
11.- Garcia H, del Brutto OH, Nash TE, White C, tsang VCM, Gilman RH. New concepts in the diagnosis and management of neurocysticercosis (Taenia solium). Am J Trop Med Hyg 2005; 72(1): 3-9.
12.- García HH, González AE, Evans CAW, Gilma RH, for the Cysticercosis Working Group in Peru. Taenia sollium cysticercosis. Lancet 2003; 361: 547-56.
13.- Álvarez E, Torres R, Gutiérrez A, Cabello J, Espinos D. Neurocistecercosis: recomendaciones de tratamiento a propósito de tres casos. An Med Interna (Madrid) 2004; 21 (8): 382-386.
14.- Nogales J, Aniagada C, Salinas R. Tratamiento de la neurocistecercosis. Rev Med Chile 2006; 134: 789-796.
CORRESPONDENCIA:
Dr. Marcos D. Iraola Ferrer
Unidad de Cuidados Intensivos
Hospital Universitario Dr. Gustavo Aldereguía Lima
Calle 51-A y Avenida 5 de septiembre.
Cienfuegos. Cuba
marcos.iraola @ gal.sld.cu
Recibido, 3 de mayo de 2012.
Publicado, 13 de mayo de 2012
