Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
PATOGÉNESIS DEL DENGUE HEMORRÁGICO (DH)
SÍNDROME DE CHOQUE DEL DENGUE (SCD).
Irma Pérez Contreras1,2, Juan Ulises Villanueva Morales 2,
Miguel Ángel Salinas Paredes2, Miguel Ángel Enríquez Guerra1,2,
Ricardo Pérez Fuentes2,3.
1Ciencias de la Salud Pública.
2Facultad de Medicina de la Benemérita Universidad Autónoma de Puebla
3Instituto Mexicano del Seguro Social.
Puebla. México
irmpecon @ gmail.com
Rev Electron Biomed / Electron J Biomed 2013;1:37-49
Comentario del revisor Prof. Dr. José María Eirós Bouza MD. PhD. Catedrático de Microbiología. Facultad de Medicina de la UNiversidad de Valladolid. España.
Comentario del revisor Dr. Santiago González Quijada MD. PhD Sección de Medicina Interna. Hospital Universitario de Burgos. España.
RESUMEN:
En la patogénesis del dengue hemorrágico (DH) existen aún muchas interrogantes por contestar y la identificación de pacientes con alto riesgo de desarrollar esta patología sigue siendo un reto en la actualidad.
Existen varias hipótesis con respecto al desarrollo de este padecimiento, algunas enfocadas a las características moleculares del virus, y otras a las formas clínicas de la enfermedad así como los posibles mecanismos inmunológicos como la activación de la inmunidad innata, los anticuerpos naturales, el estado físico del virus, las reacciones mediadas por anticuerpos, el rol del sistema de complemento así como también la cascada de citocinas e incluso una base genética de la susceptibilidad al DH.
En este trabajo se abordan diferentes hipótesis para la dilucidación de la patogénesis del Dengue Hemorrágico
PALABRAS CLAVE:Dengue hemorrágico. Dengue severo. Patogénesis.
SUMMARY:
There are still many questions to answer on the pathogenesis of hemorrhagic dengue (HD), and the identification of patients with a high risk of developing this disease still continues to be a challenge today.
There are several hypothesis as regards the development of HD, some focused on the molecular characteristics of the virus, and others on the clinical forms of the disease. Others include the possible immunological mechanisms, such as innate immunity, natural antibodies, the physical state of the virus, antibody-mediated reactions, the role of the complement system, as well as the cytokine storm, and even the genetic basis of susceptibility to HD.
This work will look at these different hypotheses in order to elucidate the pathogenesis of Hemorrhagic Dengue.
KEY WORDS: Dengue Hemorrhagic. Severe dengue. Pathogenesis.
INTRODUCCIÓN
A nivel mundial el dengue ha sido reconocido como una de las enfermedades emergentes más importantes en la actualidad. Aunque esta enfermedad normalmente causa una infección auto-limitada, algunos pacientes pueden desarrollar una enfermedad potencialmente mortal, el Dengue Hemorrágico (DH) /Síndrome de choque por dengue (SCD), la dilucidación del porque algunos pacientes pueden presentar este evento no está aún claro.
Se han propuesto varias hipótesis derivadas de estudios de investigación in vitro e in vivo con respecto a características moleculares del virus, las formas clínicas de la enfermedad así como los posibles mecanismos inmunológicos como la activación de la inmunidad innata, los anticuerpos naturales, el estado físico del virus, las reacciones mediadas por anticuerpos, el rol del sistema de complemento así como también la cascada de citocinas e incluso una base genética de la susceptibilidad al DH. En este artículo se mostrarán algunas de ellas que han tenido mayor peso en la investigación del DH/SCD.
2. Fiebre por dengue (FD), Dengue Hemorrágico (DH):
El dengue es una enfermedad que es producida por un arbovirus de la Familia Flaviviridae, transmitido al humano por la picadura de algunas especies de mosquitos infectados, de los géneros Aedes (o Stegomyia) como A. aegypti, A. albopictus principalmente y Ochlerotatus, actualmente se reconocen al menos 22 especies de vectores distribuidos en distintas regiones bio-geográficas1. Este virus tiene cuatro serotipos, DENV-1, DENV-2, DENV-3 y DENV-42.
Cada año, alrededor de 50 a 100 millones de personas en el mundo son infectadas con este virus; de éstas, entre 250 000 y 500 000 se convierten en casos de Dengue hemorrágico (DH) y 25 000 fallecen2. Del total de los casos infectados, 40 millones se diagnostican como clínicamente aparentes3; estos casos representan un espectro de enfermedades que van desde una enfermedad aguda llamada fiebre del dengue (FD) a la grave y potencialmente mortal que es el Dengue Hemorrágico/Síndrome de Choque del Dengue (DH/SCHD) o dengue severo4, 5.
El DH o dengue severo, se caracteriza por la presencia de hemoconcentración debida a la fuga de plasma al espacio extravascular por aumento en la permeabilidad de los vasos sanguíneos, lo que determina la severidad del cuadro clínico y lo diferencia de la FD. Dicha hemoconcentración se manifiesta por hematocrito elevado y con frecuencia por la presencia de hemorragias (epistaxis, gingivorragia, sangrado urogenital, sangrado en sitios de punción, hemoptisis y sangrado del tubo digestivo) y la extravasación de líquidos (equimosis, hematomas o petequias).
El cuadro de DH, e incluso SCD, puede presentarse dos o tres días después de haber desaparecido los síntomas y aún la fiebre. Otros datos que suelen acompañar al DH son: dolor en área hepática, dolor abdominal, derrame pleural, ascitis, edema en diversos órganos, hepatomegalia o esplenomegalia, leucopenia inicial y leucocitosis posterior, hiponatremia, hipo-albuminemia, hipotensión con tendencia al acortamiento en el intervalo sistólico/diastólico.
Suelen presentarse además los siguientes datos: niveles elevados de aspartato sérico, aminotransferasas, nitrógeno y urea en sangre, albuminuria y, en algunos casos, reducción de los factores de coagulación y factores fibrinolíticos, tiempo prolongado de protrombina y parcial de tromboplastina; la radiología puede revelar un derrame pleural o líquido libre en cavidad abdominal. Durante el cuadro pueden presentarse complicaciones graves, como choque, insuficiencia hepática y renal; el daño hepático puede ser severo por lo que deberá monitorizarse el funcionamiento del hígado en forma sistémica; así mismo, se puede encontrar un cuadro de encefalopatía por hipoxia, edema cerebral, daño hepático, hemorragia intracraneal o alteraciones hidroelectrolíticas; también es frecuente un cuadro respiratorio no cardiógeno.
Por otra parte, la insuficiencia renal suele ser consecuencia de la hipovolemia especialmente en el SCD, por lo que deberá tenerse especial cuidado en el manejo de líquidos y evitar como complicación un edema pulmonar6.
El Síndrome de choque (SCD) suele presentarse en el curso de un cuadro de DH, por lo general entre el tercero y quinto día de evolución; sin embargo, de acuerdo a la literatura, puede manifestarse inmediatamente dos o tres días después de un FD y excepcionalmente en pacientes asintomáticos o con cuadro febril inespecífico de dengue. Como en todo cuadro de choque, hay manifestaciones de insuficiencia circulatoria: piel fría y congestionada, cianosis peri-bucal o de las extremidades, vómito, llenado capilar lento taquicardia, tensión arterial disminuida o imperceptible, o bien reducción de la tensión diferencial (sistólica/diastólica) a menos de 20 mm/Hg, pulso rápido y débil o imperceptible, oliguria; puede haber además inquietud, agitación y alteraciones en el estado de conciencia como letargo o confusión. Se han identificado los siguientes signos de alarma que hacen inminente el cuadro de choque en un paciente de DH, permitiendo un manejo oportuno: dolor abdominal intenso y sostenido que pasa a ser uno de los componentes sintomáticos del cuadro al dato cardinal, vómito persistente, caída brusca de temperatura, de hipertermia a hipotermia, con frecuencia acompañada de sudoración, adinamia y lipotimias, inquietud o somnolencia6.
2.1 fisiopatología:
La razón por la que el DH / SCD se produce en algunas personas no está claro. Los estudios realizados en las regiones endémicas sugieren que los anticuerpos preexistentes son un factor de riesgo para desarrollar de DH / SCD. La viremia y la trombocitopenia son las principales características de la infección por el virus del dengue.
En varios estudios realizados han encontrado una correlación significativa entre la cantidad de virus circulantes en los pacientes y el desarrollo de las formas graves de dengue. Un hallazgo crítico en los pacientes con dengue severo es la depresión transitoria de células hematológicas; sin embargo, las células responsables del aumento de la viremia del dengue están sin resolver a pesar de los intensos esfuerzos realizados.
El virus del dengue parece replicar y proliferar en muchas líneas celulares adaptadas, pero estas propiedades in vitro han sido extremadamente difíciles de ser reproducida en células primarias o in vivo2,7. Las características fisiopatologías que determinan la severidad de la enfermedad y que lo diferencia del FD son: perdida del plasma como resultado del aumento de la permeabilidad vascular y la hemostasia anormal, que ocurre en un grupo selecto de pacientes durante el curso de la infección por dengue8.
El mecanismo subyacente que causa la DH/SCD es un tema de intenso debate entre investigadores. La evidencia actual sugiere que la respuesta inmune generada por el virus del dengue desempeña un papel clave en la cascada fisiopatológica de esta enfermedad9; también se ha asociado a niveles elevados de citosinas pro-inflamatorias en suero de pacientes infectados10, así como otros mediadores producidos por las células fagocíticas y el mimetismo de anticuerpos11.
Los pacientes que evolucionan a SCD fallecen a causa de la disfunción multi-orgánica y coagulación intra-vascular diseminada (CID). La duración del choque puede ser breve y acompañada de encefalopatía debido a trastornos metabólicos y electrolíticos15.
3. Características del virus del dengue:
Es un virus ARN, monocatenario en sentido positivo, empaquetado dentro de una proteína y rodeado por un andamio icosaédrico y envuelto en una capa de lípidos7. Mide aproximadamente 50 nm de diámetro y el genoma viral alrededor de 11 Kb de longitud (una kilo-base, en genética, es equivalente a 1000 pares de bases de ADN)12.
El genoma del virus codifica 3 proteínas estructurales y 7 no estructurales (ver figura 1)2. Las 7 no estructurales (NS1, NS2A, NS2B, NS3, NS4A, NS4B Y NS5) están involucradas en la patogénesis de la enfermedad severa. NS1 está implicada en la replicación del ARN viral y se expresa en la superficie de las células infectadas sin formar parte del virión13. Los niveles de NS1 secretada se correlacionan positivamente con los títulos virales14. Los niveles elevados de NS1 podrían implicar un papel importante en la formación de complejos inmunes en el DH13.
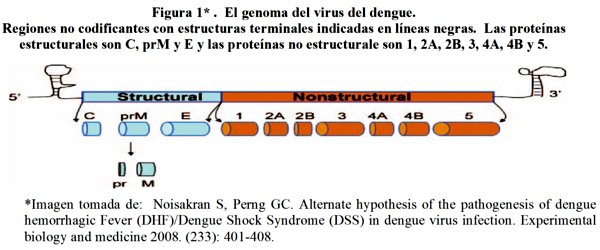
La síntesis de la proteínas virales y ARN viral ocurren predominantemente en el citoplasma de las células hospederas. La replicación es lenta y comienza dentro de las 15 horas después de la infección7. Las proteínas de la envoltura, con la que el virus se une a receptores de las células anfitrión, lleva a cabo las funciones biológicas del virus, incluido el transporte del genoma viral en la célula huésped, la hemaglutinación de los eritrocitos, la inducción de anticuerpos neutralizantes, y las respuestas inmunes protectoras15.
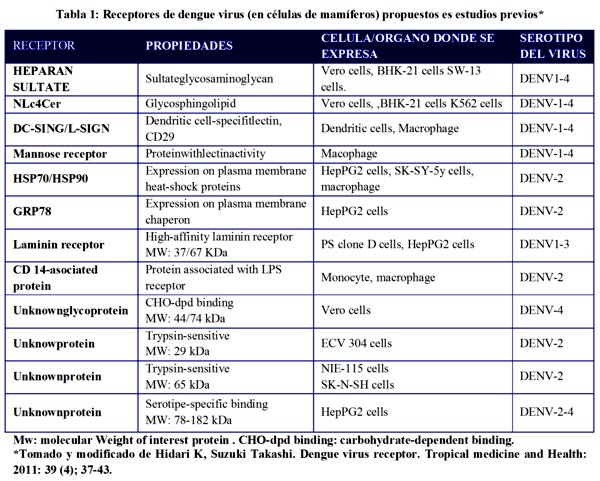
4. Receptores del virus del dengue en células de mamífero:
Halstead et al11, demostraron por primera vez que la infección el virus del dengue en leucocitos humanos de sangre periférica fue potenciada por la presencia de un anticuerpo no neutralizante. Esta reacción se vio mediada por receptores Fc gamma expresada en leucocitos. Estos resultados indican que la respuesta en la infección severa esta mediada por el receptor Fc en particular en la infección con un serotipo diferente al de la infección primaria16.
Con respecto a la infección primaria y el contacto inicial del virus con las células hospederas, las investigaciones han estado dirigidas a la identificación de las moléculas receptoras en células de mamífero. La tabla 1 presenta un resumen de los receptores del virus en células en mamíferos, propuestos en varios estudios 17.
En los últimos 30 años se han realizado varios estudios para identificar y caracterizar los receptores que identifican el virus del dengue en las células hospederas. Varias moléculas se han propuesto como posibles receptores en células humanas y de mosquito12. En células de mamífero, los glicosaminoglicanos sulfatados (GAG's), lectinas que reconocen hidratos de carbono, glucoesfingolípidos (GSL), proteínas de unión a laminina, proteínas chaperonas y proteínas no definidas han sido reportadas como candidatos17,18,19.
Otros estudios realizados por varios grupos de investigación sugieren que el Sulfato de Heparán y DC-SING (Células dentríticas específicas de la molécula de adhesión intercelular 3-acaparamiento no integrina) son indispensables para la infección por el virus en los seres humanos20, 21. Se piensa que el Sulfato de Heparán es un co-receptor que se asocia a otro grupo de moléculas para formar complejos funcionales y mejorar la eficacia de la infección del virus en las células hospederas12. El virus del dengue infecta a las células dendríticas a través de DC-SING específicamente expresados en este tipo de células. Otros estudios proponen que las moléculas de carbohidratos presentes en la matriz extracelular están fuertemente relacionadas con los receptores del virus del dengue15.
El conocimiento de los mecanismos moleculares que subyacen en la interacción del virus del dengue con el receptor (s) en células humanas y/o de mosquitos es esencial para comprender la patología del dengue. Además, descubrir el mecanismo molecular(s) de entrada del virus es crucial para el desarrollo de nuevas terapias eficaces para el tratamiento de pacientes con esta patología. Investigaciones adicionales para dilucidar la naturaleza molecular del complejo DENV (1, 2, 3, 4) receptor son necesarias4.
5. Hipótesis sobre la patogénesis de DH/SCD:
Existen varias hipótesis sobre la patogénesis del DH/SCD en individuos infectados con el virus del dengue. Estas son predominantemente derivadas de datos obtenidos en estudios realizados en regiones de países donde la enfermedad se produce de forma epidémica, y en experimentos in vitro2. Estas incluyen patogénesis dependiente de anticuerpos22, patogénesis mediada por células T2, fenómeno de tormenta de citoquinas22, antecedentes genéticos15, la diferencia entre tipos del virus2, cantidad de virus en circulación durante la fase aguda23 y el estado nutricional de los individuos infectados22.
Algunas otras hipótesis sugieren varios factores estrechamente asociados a la infección por el virus del dengue y que no han sido dilucidados en su totalidad2, entre estos se encuentran los factores relacionados con el calentamiento global, el estado físico del individuo infectado, transmisión vectorial, así como el sistema inmune innato, en el que está incluido el sistema del complemento, además del papel de las plaquetas en la patogenia de DH/SCD y la activación de células T2,4,15,23.
Las interacciones entre el virus y el huésped que llevan a la inmunidad protectora frente a la patogénesis de la enfermedad, así como los mecanismos de la inmunidad anti-DENV, han sido poco estudiadas, enfocándose más al estudio del examen de la función del sistema inmune en el contexto de la patogénesis2. Comprender los mecanismos que regulan el equilibrio inmune entre la patología y la protección es fundamental para el desarrollo seguro y eficaz de tratamientos y vacunas contra el DENV23.
5.1 Transmisión vectorial :
El dengue es transmitido por la picadura del mosquito portador de la partícula infecciosa (DENV). El vector puede servir como un anfitrión biológico (transmisión biológica) lo cual quiere decir que el virus requiere replicarse dentro del vector antes de ser transmitido a su nuevo hospedador (mamífero), o solo el virus requiere al vector como vehículo de transmisión (transmisión mecánica), es decir que el virus del dengue no requiere replicarse dentro del vector antes de que pueda ser transmitido a su nuevo objeto.
Si bien existen varios estudios sobre la transmisión biológica del DENV en el mosquito vector, hay poca información sobre la transmisión mecánica del DENV. En las zonas endémicas, especialmente durante las epidemias, la transmisión mecánica puede desempeñar un papel importante en la propagación del DENV, en ambos casos el vector parece inyectar directamente el virus en el vaso sanguíneo capilar2.
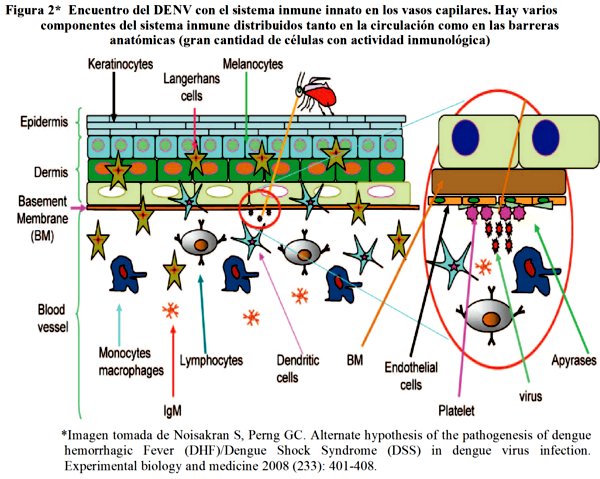
La infección se inicia con la inyección del virus desde el mosquito vector a la corriente sanguínea del hospedero, pareciendo lógico que inicialmente en esta etapa el virus se encuentre con el sistema inmune innato del anfitrión (ver figura 2). Por lo tanto parece razonable llevar acabo estudios detallados sobre estos primeros eventos para poder identificar estrategias terapéuticas dirigidas a la prevención y desarrollo de DH/SCD en los periodos iníciales de la infección2.
5.2 Estado físico del virus en individuos virémicos.
La viremia es la principal característica del DENV y única entre la familia flavivirus. La evidencia física de que si el virus se encuentra como una partícula libre, o está asociado a células y/o se encapsula en la membrana de la célula hospedera, es poco conocido2.
La viremia puede estar causada por la presencia del virus en el plasma (partícula viral libre) o estar asociado a células, dentro de las plaquetas, linfocitos, monocitos, pero no probablemente en eritrocitos. En el caso de la viremia plasmática la cantidad del virus circulante es un factor crítico, los resultados de estudios sugieren que la mayoría de los virus circulantes en sangre están asociados a células25. De importancia es el hecho de que el virus asociado a células ayuda a propagar el virus en todo el cuerpo. Cabe destacar que también ha sido demostrado que el virus puede circular en forma de complejos inmunes, pero aun faltan estudios precisos sobre la cinética de cómo ocurre esto2.
Ha sido complejo estudiar durante la viremia aguda a los pacientes humanos, puesto que tales pacientes se ven solamente envueltos en un cuadro febril. Es posible que después de la entrada del DENV en el torrente sanguíneo, el virus se introduzca a una célula permisiva donde se replica en cantidad suficiente para inducir la respuesta febril, después de lo cual pueden existir varias formas de evolución dependiendo del grado de viremia y de la respuesta del anfitrión frente a esta.
Realizar análisis minuciosos sobre estos primeros eventos durante el curso de la infección por DENV, tales como la cinética de la viremia asociados con cada etapa y la forma en la que existe el virus durante las mismas, pueden proporcionar una perspectiva en cuanto a las propiedades físicas de las partículas virales circulantes en sangre y conducir a la identificación de dianas únicas para una vacuna preventiva del desarrollo de la patogénesis de DH/SCD2.
5.3 Sistema inmune innato:
El sistema inmune innato es la forma más antigua de defensa del huésped frente a la infección. Se ha documentado que este existe sin formas detectables del sistema inmune adaptativo en especies filogenéticamente más primitivas, lo que sugiere que ha tenido más tiempo evolutivo. Consta de varios componentes que en general van desde la piel hasta mecanismos efectores celulares y la codificación de moléculas por el genoma que actúan en sintonía para proteger al organismo de agentes extraños. Incluye anticuerpos naturales y factores implicados en el mantenimiento de la homeostasis2, 26,27. Sus características clave son la especificidad para reconocer el antígeno y que puede responder inmediatamente al contacto de este25.
La respuesta de defensa inicial es eliminar o contener temporalmente a los agentes extraños y de este modo reducir o prevenir la infección. La respuesta a la infección por dengue virus en el periodo entre la infección y la aparición de signos clínicos es un evento que deberá de ser investigado con mayor profundidad.27.
5.4 Anticuerpos naturales IgM:
La inmunidad humoral es principalmente mediada por células B, que producen diferentes clases de anticuerpos, tanto naturales como inducidos por patógenos. Los anticuerpos naturales IgM son producidos principalmente por CD5þ células B (células B1) y son un componente de la inmunidad innata28. Estos anticuerpos naturales circulantes no son específicos pero pueden unirse a patógenos, y así garantizar una protección temprana26. Los anticuerpos naturales pueden facilitar la captación de antígenos, el procesamiento, y presentación por parte de los linfocitos B a través del complemento y los receptores Fc28.
Se ha sugerido que las células B son las principales células mono - nucleares circulantes en infectados por virus del dengue30. Interacciones entre la inmunidad innata y la respuesta inmune adaptativa son ahora ampliamente visto como esenciales para una respuesta inmune normal30.
En los seres humanos el 30% de los anticuerpos en circulación son moléculas pentaméricas de IgM, también circulan una pequeña cantidad de hexamérica IgM, IgG e IgA naturales. Los anticuerpos IgM naturales están involucrados en el reconocimiento temprano de invasores externos y la eliminación de patógenos, como las bacterias y los virus26,28. La estructura multimérica de IgM es un fuerte activador del complemento; un pentámero de IgM enlazado puede desencadenar la vía clásica de activación del complemento, mientras que se requieren aproximadamente mil moléculas de IgG para realizar lo mismo32. Además, la IgM hexámero, a pesar de que circula en cantidades más pequeñas, es de 15 a 20 veces más eficiente en activar el complemento que la forma pentamérica de IgM33.
Los complejos inmunes circulantes (CIC) en el suero de pacientes con DH / SCD fue reportada primero por Theofilopoulos et al en 19762. El antígeno del dengue puede ser detectado en más del 50% de los CIC, y el aumento de los valores de plaquetas asociados a IgM se ha observado en casos de DH2. El complejo inmune de IgM ha sido encontrado consistentemente en las paredes de los vasos sanguíneos de papilas dérmicas o erupciones cutáneas de pacientes con dengue34. Sin embargo, el origen y la estructura de IgM en estos complejos inmunes no se han caracterizado2.
El papel de los complejos inmunes de IgM circulantes en DH / SCD es poco conocido. Tal vez, los complejos inmunes que se adhieren a la superficie de las plaquetas pueden aumentar la destrucción de las mismas por el sistema retículo-endotelial en el hígado y el bazo, dando lugar a trombocitopenia durante la fase de choque en la enfermedad. Por lo tanto, los niveles de IgM, en particular de IgM naturales que tiene especificidad para el virus del dengue en un individuo pueden tener un impacto en el desarrollo de la infección y progresión del DH/SCD.
5.5 Las plaquetas:
Las plaquetas son un elemento esencial en la hemostasia. En estudios recientes han sido catalogadas como parte integral del sistema inmune innato y pueden ser efectores potentes de su respuesta35. Se ha demostrado que una molécula funcional CD154 (CD 40L) mejora la presentación de antígenos y aumenta la respuesta inmune adaptativa y se expresa en la superficie de las plaquetas36. Esto apoya el papel de las plaquetas en modulación de la respuesta inmune y la inflamación37.
Los megacariocitos se producen en la medula ósea, y son los que dan origen a las plaquetas, estas son a-nucleadas rodeadas por membrana así como de citoplasma y gránulos de los mismos35. Circulan por los vasos sanguíneos y funcionan para controlar la integridad del sistema vascular. Hay dos formas de plaquetas circulantes, unas de reposo como discos y una forma activa como filopodios.
Estructuralmente, la configuración del cito-esqueleto en estas formas es diferente ya que tienen diferentes conjuntos de actina y micro-túbulos36. Cuando el revestimiento de un vaso sanguíneo está traumatizado, las plaquetas son estimuladas a través de diversos mediadores para ir al sitio de la lesión, donde forman un tapón para reducir la pérdida de sangre.
Todas las respuestas funcionales de las plaquetas deben estar estrictamente reguladas para asegurar la formación del coágulo, que debe ser del tamaño suficiente para sellar el área dañada, sin interrumpir u ocluir el flujo de sangre a los órganos vitales37. Por lo tanto, el deterioro de su función puede aumentar el riesgo de fragilidad vascular dando lugar a una hemorragia. Esto puede ser un mecanismo importante de pérdida de plasma en formas graves de dengue2.
Una de las principales manifestaciones clínicas de la enfermedad del dengue es la trombocitopenia2. Esto surge debido a la disminución en producción y aumento en la destrucción de las plaquetas36. El grado de trombocitopenia así como la activación del complemento no parecen estar correlacionada con la gravedad clínica de DH2,4.
Durante la infección por el virus del dengue, las plaquetas pueden proporcionar un escudo maravilloso para el virus frente a la neutralización de anticuerpos preexistentes. Hay algunos estudios que sugieren que el virus de dengue puede asociarse con plaquetas, directa o indirectamente, a través de anticuerpos2. Asumiendo que este es el caso, se puede suponer que los complejos virus-anticuerpo-plaquetas pueden aumentar la fagocitosis o ser devorados por los macrófagos o monocitos a través del receptor de Fc como se ha sugerido por otros autores34.
Últimamente se demostró que el DENV utiliza una polimerasa con transcripción inversa y se ha hallado purificado en plaquetas de pacientes infectados con el virus2. El punto interesante de estos hallazgos es que la trombocitopenia que se ve en pacientes con DH / SCD no sólo se produce por la destrucción de las plaquetas sino también por el virus (citotoxicidad directa), pero además puede ser causada por la destrucción de las plaquetas después de la unión de anticuerpos específicos del DENV contra las plaquetas infectadas con virus (inmuno-toxicidad mediada por anticuerpos)38. También es posible que las plaquetas puedan servir como un reservorio para la replicación del virus del dengue2.
5.6 Sistema del complemento
El estudio realizado por Avirutnan et al39 ha arrojado datos sobre el doble papel del sistema del complemento en la protección y en la patogénesis de la infección por DENV.
El sistema del complemento, está integrado por más de 30 diferentes proteínas de superficie celular y otras solubles, es un componente importante de la respuesta inmune innata contra diferentes patógenos que se activa a través de las vías clásicas, lectina y alternativa, mismas que controlan las infecciones virales a través de múltiples mecanismos, incluyendo la lisis de los viriones o células infectadas.
La vía clásica se activa por la unión de C1q a los complejos antígeno-anticuerpo; la vía de la lectina implica el reconocimiento de carbohidratos de las estructuras de patógenos a través de lectina fijadora de manosa (MBL) y la vía alternativa que se activa a niveles bajos a través de la hidrólisis espontánea de C34.
La mayoría de los estudios que examinan las interacciones entre DENV y sistema de complemento se han centrado en el papel que juega el complemento en la patogénesis de SCD4.
Avirutnan et al40 en un estudio prospectivo realizado propuso que la proteína no estructural 1 (NS1) del DENV podría activar el complemento, y por otro lado, altos niveles de NS1 y varias proteínas del complemento se ha encontrado que están correlacionados con la gravedad de la enfermedad41.
Shresta en otro estudio prospectivo demostró que los niveles de los factores del complemento D y H (es decir, proteínas reguladoras de la vía alternativa) y la proteína MBL se encontraron más elevados en pacientes con DH que en los de FD (fiebre del dengue)4. Estos estudios postulan una relación entre la actividad de NS1 y la activación del complemento o una alteración en la regulación de la activación del complemento en la patogenia del dengue, dando un papel importante al sistema del complemento en el contexto de la inmunidad protectora.
En estudios in vitro han demostrado que ADE (aumento de la infección dependiente de anticuerpos) reduce las proteínas del complemento en la infección por DENV lo que sugiere que el complemento puede jugar un papel en la limitación de la enfermedad mediada por ADE4.
Recientemente, los estudios in vitro con NS1 de DENV han señalado que la proteína viral se une a C4 y C1s40 o C4BP para antagonizar la activación del complemento, lo que implica que NS1 es una molécula de evasión del sistema inmune in vivo43. Otros estudios muestran cómo DENV pueden emplear mecanismos múltiples para revertir la activación del complemento y sugieren que el sistema del complemento es un importante factor en la defensa del huésped contra DENV42.
En otro estudio realizado por el grupo de Avirutnan et al.39 examinó el papel del sistema del complemento en la protección contra la infección de DENV, y los resultados obtenidos indican que este sistema tiene un papel importante en el control de la infección por DENV y en la gravedad del dengue en humanos4. Este mismo grupo de investigadores han realizado experimentos usando sueros de ratón para determinar qué vías del complemento contribuyen a la neutralización de DENV in vitro39.
Experimentos con modelos en ratón con pérdida de función de varias proteínas del complemento demostraron que la vía MBL era crítica para la neutralización del serotipo DENV-2,4,39. Basándose en estos resultados, los autores realizaron experimentos adicionales purificando y utilizando MBL humano y demostraron que esta podría directamente neutralizar DENV-2 y dicha neutralización fue más eficiente a temperaturas más altas (37° C y 40° C) que a temperatura ambiente4.
En conjunto, estos resultados y observaciones sugieren que la vía MBL contribuye a la protección contra la infección por DENV en los seres humanos. Las deficiencias en la MBL son relativamente comunes en los seres humanos. La deficiencia de MBL ha sido asociada con una mayor susceptibilidad a muchas enfermedades infecciosas, incluyendo las infecciones virales4,44.
5.7 Aumento de infección dependiente de anticuerpo. ADE:
Durante las infecciones secundarias con un serotipo del virus del dengue (heterotipo) existe una fuerte evidencia en estudios in vitro como in vivo que sugieren que los niveles pre-existentes, no-neutralizantes, y no protectores de anticuerpos contra dengue aumentan la replicación del virus en células con receptor Fc, especialmente monocitos y macrófagos21.
Estudios sero-epidemiológicos llevados a cabo durante las epidemias de DH en Cuba en 1981, 1997 y 2001-200223 y en otras zonas endémicas confirmó que la infección por dengue secundario fue un factor de riesgo significativo en más de 97% de los casos graves21 y después de la infección primaria, especialmente por DEV-2 y DEV-3 y después de una primera por DENV-1. Sin embargo, todos los serotipos de dengue se ha demostrado que son capaces de causar DH/SCD en contraste con la enfermedad más leve que se asocia a cargas menores virales y altos niveles de anticuerpos neutralizantes preexistentes en infección secundaria heterotípica.
Además el ADE, realiza reacción cruzada contra la proteína NS1 relacionada con el daño a células endoteliales al inducirlas a apoptosis. Los estudios in vitro indican que la producción de citoquinas y quimioquinas en células endoteliales, incluida la interleucina-6 (IL-6), IL-8 y MCP-1(Proteína quimiotáctica de monocitos 1), se encuentran aumentadas después del tratamiento con anticuerpos anti-NS1 que sugiere la posibilidad de una enfermedad auto-inmunitaria en la patogénesis de DH/SCD basado en el "mimetismo molecular"23.
También, anticuerpos en la reactividad cruzada con el plasminógeno (debido a una similitud a la glicoproteína de la envoltura del DENV y una familia de factores de coagulación) podrían desempeñar un papel en la etiología de la hemorragia en el DH/SCD23. Se ha observado la persistencia de anticuerpos NS1 por mucho tiempo después de que la infección por dengue se ha resuelto. Por lo tanto, esto puede ser importante para entender cómo tales mecanismos autoinmunes están limitados cuando la infección se está produciendo.
Más reciente, en resultados preliminares, una investigación propuso el posible papel de la citotoxicidad celular dependiente de anticuerpos ADCC45, esta actividad se detectó en sueros de pacientes con DH, pero no de los pacientes con la fiebre del dengue, por lo tanto se sugiere un posible papel de ADCC en la patogénesis de DH / SCHD. Se requiere investigación adicional para comprender plenamente el significado completo y el papel de ADCC en la patogenia de DH / SCD y su importancia en la activación de células T23.
5.8 Activación de células T:
Hay una fuerte evidencia de la activación de células T in vivo durante la infección por DENV y tal activación de las células T CD4+ y CD8+ es mayor en los pacientes con DH que en los que tienen FD45. Después de la ADE (aumento de la infección dependiente de anticuerpos) y de la replicación viral en monocitos y macrófagos se presentan antígenos virales en conjunto con moléculas antígeno de linfocitos humanos en la superficie de dichas célula.
A continuación se produce la activación de células CD4+, Células CD8+ y Células T de memoria que fueron sensibilizadas durante una infección previa lo que conduce a la proliferación y liberación de citoquinas pro-inflamatorias tales como interferón gamma (IFNg) y factor de necrosis tumoral alfa (TNFa)46,47. Estas citoquinas pueden actuar directamente sobre las células endoteliales vasculares que resulta finalmente en la fuga del plasma23.
Estudios en niños con DH/SCD evidenciaron la asociación de la enfermedad con altos niveles de activación de células T acompañadas de una masiva apoptosis21. Un estudio realizado en niños tailandeses infectados por DENV concluyó que las células T muestran una baja afinidad por el virus infectante (virus de infección previa) y una mayor afinidad por otro serotipo, la reacción cruzada presente en el dengue específicamente generada por las células T ha demostrado que induce a la exacerbación de la producción de citoquinas y con ello al aumento de la permeabilidad vascular induciendo a DH/SCD23,48.
5.9 Cascada/tormenta de citoquina:
Actualmente se cree que después de la activación masiva de linfocitos T de memoria, una cascada de citoquinas actúa sobre las células endoteliales vasculares, lo cual sería el evento crítico que conduce a la fuga de líquidos y proteínas. Las concentraciones de citoquinas por las células T, monocitos, macrófagos y células endoteliales se ha demostrado que se encuentran incrementadas en suero de pacientes con DH/SCD y en especial TNFa, IL-2, IL-6, IL-1, IL-8b e IFNg. Estos hallazgos tienen el respaldo de estudios en los que se analizaron sueros de pacientes con DH/SCD originarios de Vietnam, India y Cuba, quienes mostraron niveles altos de IFNg y TNFa e IL-10.
También existen evidencias científicas que demuestran que las citoquinas pueden inducir a la liberación y producción de otras citoquinas, esta compleja red interactiva provoca inducción de nuevas elevaciones en los niveles de citoquinas y otros mediadores químicos23. Las citoquinas también tienen a menudo efectos sinérgicos, por ejemplo, TNFa, IL IFNg 1-ADE y juntas pueden inducir un aumento mayor en la permeabilidad, en comparación a cuando cada una de estas citoquinas actúa de forma individual. Además, IFNg también es capaz de incrementar la expresión de los receptores de FCG en monocitos y macrófagos facilitando así la replicación viral23.
La respuesta de las citoquinas está estrechamente ligada a la activación de células T y es aceptado que l ADE-VIRAL active una secuencia de liberación de citoquinas que estrictamente no es un proceso lineal, sino más bien una compleja interacción de acontecimientos patológicos que en última instancia desencadenan la aparición de DH/SCD, caracterizado por aumento de la permeabilidad vascular e insuficiencia circulatoria.
La probabilidad de que las citoquinas, en lugar de los virus sean responsables del daño a las células endoteliales durante DH fue sugerido por un estudio inmuno-patológico en tejidos humanos de pacientes con DH donde la presencia de antígenos de dengue en las células endoteliales se pensaba que era debido a la deposición de complejos virus-anticuerpo en lugar de la replicación viral que se produce en monocitos y macrófagos40.
5.10 Base genética de DH/SSD:
La diversidad de las manifestaciones clínicas de las infecciones de dengue plantea la posibilidad de una base genética para la regulación de la expresión de esta enfermedad. La resistencia al DH observado en los cubanos de ascendencia africana y mayor riesgo en negroides de ascendencia caucásica apoyan la hipótesis genética15.
Se ha demostrado que algunas enfermedades están asociadas con los alelos del antígeno leucocitario humano (HLA), el receptor de la vitamina D y Fc?IIa el polimorfismo del locide HLA de clase1 loci el cual fue encontrado asociado con una mayor susceptibilidad a DH en Vietnam49. Esta asociación fue confinada a la región HLA-A y no del gen HLA-B. Los niños con HLA-A * 24 fueron más susceptibles para DH en comparación con los niños con HLA-A * 33 Además, HLA-A * 0203 se encontró que se asocia con infecciones por dengue menos graves, independientemente del serotipo del virus infectante en las infecciones secundarias.
El polimorfismo en cinco genes HLA es decir, IL-4, IL-1RA, MBL, VDR, y FccRII se encontró que pueden aumentar la susceptibilidad a DH. Una mutación funcional en la región promotora de DC-SIGN se asoció con la susceptibilidad a dengue leve, pero no a DH50. La acción inmuno-reguladora del receptor de la vitamina D incluye la activación de monocitos, la estimulación de respuestas inmunes celulares, y la supresión de la producción de inmunoglobulina y proliferación de linfocitos15.
6. CONCLUSIÓN:
Las hipótesis planteadas en este artículo derivadas de estudios in vivo e in vitro, proponen varios mecanismos para dilucidar la patogénesis del DH/SCD, varios de ellos no necesariamente excluyentes como se sugiere con la presencia de los niveles pre-existentes, no-neutralizantes, y no protectores de anticuerpos, con reactividad cruzada contra la proteína NSI del virus del dengue, los cuales podrían estar asociados al aumentado de la replicación del DENV en células con receptor Fc, especialmente monocitos y macrófagos y, relacionados con el daño a células endoteliales al inducirlas a apoptosis.
El otro mecanismo relacionado implica a los linfocitos CD8 específicos contra el virus del dengue los cuales se someten a apoptosis debido al agotamiento que sufren al enfrentar a las células infectadas por este virus. Ambos mecanismos llevan a una pérdida inmunológica la cual se le ha relacionado como un disparador importante en la activación del complemento. Otro mecanismo plantea que después de la activación masiva de linfocitos T de memoria, una cascada de citoquinas actúa sobre las células endoteliales vasculares, lo cual sería el evento crítico que conduce a la fuga de líquidos.
La hipótesis que plantea una base genética se sustenta en los estudios de investigación que han evidenciado cierta resistencia al DH/SCD en determinados grupos raciales.
No se descarta que muchos de estos mecanismos propuestos puedan interaccionar y llevar al desarrollo del DH/SCD. Dilucidar la patogénesis del DH/SCD puede permitir en un futuro el establecimiento de marcadores predictivos que permitan detectar los pacientes de alto riesgo antes de desarrollar los signos y síntomas en esta enfermedad que ha causado muchas muertes a nivel mundial.
REFERENCIAS
1. Canals M, González C, Canals A, Figueroa D. Dinámica epidemiológica del dengue en la Isla de Pascua. Rev. Chilena Infectol 2012; 29 (4): 388-394
2. Noisakran S, Perng GC. Alternate hypothesis of the pathogenesis of dengue hemorrhagic Fever (DHF)/Dengue Shock Syndrome (DSS) in dengue virus infection. Experimental biology and medicine 2008 (233): 401-408.
3. Dengue Vaccine Initiative. 2012. Disease burden. http: //www. denguevaccines.org/ disease-burden.
4. Shresta S. Role of complement in dengue virus infection: Protection or Pathogenesis? mBio 2012 3(1): 1-2.
5. World Health Organization. Prevention and control of dengue and dengue hemorrhagic fever: Comprehensive guidelines. WHO Regional publication, SEARO; 1999. No 29.
6. SSA. Manual para la vigilancia, diagnóstico, prevención y control del dengue. 2011 México
7. Chambers TJ, Hahn CS, Galler R, Rice CM. Flavivirus genoma organization, expression, and replication. Annu Rev Microbiol. 1990 (44): 649-688.
8. World Health Organization. Dengue and dengue hemorrhagic fever. Chapter 6. In: WHO Report on global surveillance of epidemic prone infectious diseases, Geneva: World Health Organization, 2001.
9. Lei HY, Yeh TM, Liu HS, Lin YS, Chen SH, Liu CC. Immuno-pathogenesis of dengue virus infection. J Biomed Sci 2001.8:377-388.
10. Suharti C, van Gorp EC, Dolmans WM, Setiati TE, Hack CE, Djokomoeljanto R, van der Meer JW. Cytokine patterns during dengue shock syndrome. Eur Cytokine Netw , 2003;14:172-177
11. Lin CF, Lei HY, Shiau AL, Liu CC, Liu HS, Yeh TM, Chen SH, Lin YS. Antibodies from dengue patient sera cross-react with endothelial cells and induce damage. J Med Virol 69:82-90, 2003.
12. Zhao B, Mackow E, Buckler-White A, Markoff L, Chanock RM, Lai CJ, et al. Cloning full-length dengue type 4 viral DNA sequences: Analysis of genes coding for structural proteins. Virology. 1986; 155:77-88.
13. Young PR, Hilditch PA, Bletchly C, Halloran W. An antigen capture enzyme-linked immune sorbent assay reveals high levels of the dengue virus protein NS1 in the sera of infected patients. J ClinMicrobiol. 2000; 38:1053-7.
14. Libraty DH, Young PR, Pickering D, Endy TP, Kalayanarooj S, Green S, et al. High circulating levels of the dengue virus nonstructural protein NS1 early in dengue illness correlate with the development of dengue hemorrhagic fever. J Infect Dis. 2002;186:1165-1168.
15. Gurugama P, Garg P, Wijewickrama A, Seneviratne SL. Dengue viral infectionIndian J Dermatol. 2010, 55(1) 68-78.
16. Halstead SB, Chow JS, Marchette NJ. Immunological enhancement of dengue virus replication. Nature (London) New Biol 1973; 243: 24-26
17. Hidari K, Suzuki Takashi. Dengue virus receptor. Tropical medicine and Health: 2011: 39 (4); 37-43.
18. Lee E, Wright PJ, Davidson A, Lobigs M. Virulence attenuation of dengue virus due to augmented glycosaminoglycanbinding affinity and restriction in extraneural dissemination. J Gen Virol 2006; 87: 2791-2801.
19. Aoki C, Hidari KIPJ, Itonori S, Yamada A, Takahashi N, Kasama T, Hasebe F, Islam MA, Hatano K, Matsuoka K, Taki T, Guo C-T, Takahashi T, Sakano Y, Suzuki T, Miyamoto D, Sugita M, Terunuma D, Morita K, Suzuki Y. Identification and characterization of carbohydratemolecules in mammaliancellsrecognizedby dengue virus type 2. J Biochem (Tokyo) 2006; 139: 607-614.
20. Tassaneetrithep B, Burgess TH, Granelli-Piperno A, Trumpfheller C, Finke J, Sun W, Eller MA, Pattanapanyasat K, Sarasombath S, Birx DL, Steinman RM, Schlesinger S, Marovich MA. DC-SIGN (CD209) mediates dengue virus infection of human dendritic cells. J ExpMed 2003; 197: 823-829.
21. Lozach PY, Burleigh L, Staropoli I, Navarro E, Harriague J, Virelizier JL, Rey FA, Desprès P, Arenzan F, Amara A. Dendritic cell-specific intercellular adhesion molecule 3-grabbing non-integrin (DC-SIGN)-mediated enhancement of dengue virus infection is independent of DC-SIGN internalization signals. J Biol Chem. 2005 Jun 24; 280(25):23698-708.
22. Ranjit S, Kissoon N, Gandhi D, Dayal A, Rajeshwari N, Kamath SR. Early differentiation between dengue and septic shock by comparison of admission hemodynamic, clinical and laboratory variables: A pilot study. PediatricEmergCare. 2007;23:368-75.
23. Pang T, Cardosa MJ, Guzmán MG. Of cascades and perfect storms: the inmunopathogenesis of dengue hemorrhagic fever-dengue shock syndrome (DHF/DSS). Immunology and cell biology, 2007 (85): 43-45.
24. Thisyakorn U, Nimmannitya S. Nutritional status of children with dengue hemorrhagic fever. Clin Infect Dis 1993; 16:295-297.
25. Mandel B. Neutralization of animal viruses. Adv Virus Res 1978; 23:205-268.
26. Janeway CA, Jr., Medzhitov R. Innate immune recognition. Annu Rev Immunol 2002; 20:197-216.
27. Navarro E, Despres P, Cedillo L. Innateimmune responses to dengue virus. Arch Med Res, 2005; 36:425-435.
28. Boes M. Role of natural and immune IgM antibodies in immune responses. Mol Inmunol, 2000; 37:1141-1149.
29. Carroll MC. The role of complement and complement receptors in induction and regulation of immunity. Annu Rev Immunol 16:545-568, 1998.
30. King AD, Nisalak A, Kalayanrooj S, Myint KS, Pattanapanyasat K, Nimmannitya S, Innis BL. B cells are the principal circulating mononuclear cells infected by dengue virus. Southeast Asian J Trop Med Public Health 1999.30:718-728.
31. Medzhitov R, Janeway CA, Jr. Innate immunity: the virtues of a nonclonal system of recognition. Cell 1997; 91:295-298.
32. Cooper NR, Nemerow GR. Complement effector mechanisms in health and disease. J Invest Dermatol 1985; 85:39s-46.
33. Randall TD, King LB, Corley RB. The biological effects of IgM hexamer formation. Eur J Immunol 20:1971-1979, 1990.
34. Halstead SB. Observations related to pathogenesis of dengue hemorrhagic fever. VI. Hypotheses and discussion. Yale J BiolMed 1970: 42:350-362.
35. Weyrich AS, Zimmerman GA. Platelets: signaling cells in the immune continuum. Trends Immunol 2004.25:489-495.
36. Elzey BD, Sprague DL, Ratliff TL. The emerging role of platelets in adaptive immunity. Cell Immunol 2005; 238:1-9.
37. Hartwig JH. The platelet: form and function. SeminHematol 2006.43: S94-S100.
38. Andrews RK, Berndt MC. Platelet physiology and thrombosis.Thromb Res 2004.114:447-453.
39. Oishi K, Saito M, Mapua CA, Natividad FF. Dengue illness: clinical features and pathogenesis. J Infect Chemother 200713:125-133.
40. Avirutnan P, Hauhart RE, Marovich MA, Garred P, Atkinson JP, Diamond MS. Complement-mediated neutralization of dengue virus requires mannose-binding lectin. mBio 2011; 2:(6):e00276-1
41. Avirutnan P, et al.Vascular leakage in severe dengue virus infections: a potential role for the nonstructural viral protein NS1 and complement. J. Infect. Dis. 2006: 193:1078 -1088
42. Avirutnan P, et al. 2010. Antagonism of the complement component C4 by flavivirus nonstructural protein NS1. J. Exp. Med. 207:793- 806.
43. Avirutnan P, et al.2011. Binding of flavivirus nonstructural protein NS1 to C4b binding protein modulates complement activation. J. Immunol. 187:424-433
44. Nascimento EJ, et al.2009. Alternative complement pathway deregulation is correlated with dengue severity. PLoS One 4:e6782.
45. Garcia G, Arango M, Pérez AB, Fonte L, Sierra B, Rodríguez R et al. Antibodies from patients with dengue viral infection mediate cellular cytotoxicity. J ClinVirol 2006; 1: 53-57.
46. Rothman AL. Immunology and immunopathogenesis of dengue disease. Adv Virus Res 2003; 60: 397-419.
47. Mangada MM, Endy TP, Nisalak A, Chunsuttiwat S, Vaughn DW, Libraty DH et al. Dengue-specific T cell responses in peripheral blood mononuclear cells obtained prior to secondary dengue virus infections in Thai schoolchildren. J Infect Dis 2002; 185: 1697-1703
48. Mongkolsapaya J, Duangchinda T, Dejnirattisai W, Vasanawathana S, Avirutnan P, JairungsriA et al. T cell responses in dengue hemorrhagic fever: are cross-reactive T cells suboptimal? J Immunol 2006; 176: 3821-3829.
49. Loke H, Bethell D, Phuong CX, Day N, White N, Farrar J, et al. Susceptibility to dengue hemorrhagic fever in Vietnam: Evidence of an association with variation in the vitamin d receptor and Fc gamma receptor IIa genes. Am J Trop Med Hyg.2002; 67:102-6.
50. Sakuntabhai A, Turbpaiboon C, Casadémont I, Chuansumrit A, Lowhnoo T, Kajaste-Rudnitski A, et al. A variant in the CD209 promoter is associated with severity of dengue disease. NatGenet. 2005; 37:507-13.
CORRESPONDENCIA:
DC. Irma Pérez Contreras.
Dom. 13 sur 2702. Col. Volcanes,
Puebla, México
irmpecon @ gmail.com