Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
TOXICODERMIA ASOCIADA A BENDAMUSTINA
Idalia Valdivia1, Pilar de la Fuente2, Rodolfo Álvarez-Nuño2,
Beatriz Cuevas-Ruiz2
1Unidad de Investigación. 2Servicio de Hematología-Hemoterapia
Hospital Universitario de Burgos. Burgos. España
bcuevas @ hubu.es
Rev Electron Biomed / Electron J Biomed 2014;2:33-37
RESUMEN
La Bendamustina es un fármaco citotóxico indicado en el tratamiento de la Leucemia Linfática Crónica que puede ocasionar diversas reacciones cutáneas adversas.
Presentamos el caso de una mujer que recibió Bendamustina y presentó un exantema cutáneo
PALABRAS CLAVE: Bendamustina, Leucemia Linfática Crónica, Toxicodermia
SUMMARY:
Bendamustine is a cytotoxic drug used in the treatment of Chronic Lymphocytic Leukemia can cause various adverse skin reactions.
We report the case of a woman who received Bendamustine and developed a skin rash
KEY WORDS: Bendamustine. Chronic Lymphocytic Leukemia. Toxicodermia
INTRODUCCIÓN
Bendamustina es un fármaco citotóxico híbrido, con propiedades bifuncionales de un alquilante y un análogo de la purina1. Fue aprobado por la Food and Drug Administration de los Estados Unidos (FDA) en 2008 y está indicada su administración por vía intravenosa para el tratamiento de pacientes con Leucemia Linfática Crónica (LCC) o Linfoma no Hodgkin (LNH) indolente de células B que ha progresado a pesar del tratamiento con rituximab o un régimen que contenía rituximab2. La Agencia Española de Medicamentos y Productos Sanitarios tiene como indicaciones clínicas formalmente aprobadas el tratamiento de primera línea en LLC (estadio B o C de Binet) en pacientes en los que no es adecuada una quimioterapia de combinación con fludarabina, tratamiento en monoterapia en pacientes con LNH que hayan progresado durante o en los 6 meses siguientes a un tratamiento con rituximab o un régimen que contenga rituximab, tratamiento de primera línea del Mieloma Múltiple (estadio II con progresión o estadio III de Durie-Salmon) en combinación con prednisona, en pacientes mayores de 65 años que no son candidatos a un autotrasplante de células progenitoras y que tengan una neuropatía clínica en el momento del diagnóstico que impide el uso de tratamientos a base de talidomida o bortezomib3.
Se han descrito diversos casos de reacciones adversas cutáneas en pacientes tratados con Bendamustina, aunque en algunos casos se produjeron al combinar Bendamustina con otros fármacos por lo que su relación causal no está bien determinada.
Presentamos el caso clínico de una paciente con LLC, que tras recibir el segundo ciclo de tratamiento con Rituximab-Bendamustina junto con Alopurinol, presentó exantema cutáneo generalizado.
CASO CLÍNICO
Mujer de 76 años, sin alergias medicamentosas conocidas y con antecedentes de HTA, fibrilación auricular, epilepsia a los 20 años, temblor esencial e hipoacusia con implante coclear no funcionante.
Otros antecedentes que presentaba era un carcinoma indiferenciado de tipo histiocitoide con áreas de células en anillo de sello de mama derecha y estadiaje pT1 N0 (0/28) M0, RE (+++), RP (++), HER-2 (+/+++) por lo que se realizó mastectomía tipo madden en enero de 1996; posteriormente recibió 6 ciclos de quimioterapia adyuvante según esquema CMF (Ciclofosfamida, Metotrexato y Fluoruracilo) que fue complementada con hormonoterapia con Tamoxifeno durante 5 años.
Así mismo, en diciembre de 2011, había presentado un adenocarcinoma de probable origen ovárico versus endometrial con receptores hormonales (+) y estadio IV, recibiendo quimioterapia con 8 ciclos de Carboplatino-Taxol y mantenimiento con Letrozol tras alcanzar respuesta completa biológica y respuesta parcial radiológica.
Había precisado un ingreso por insuficiencia cardíaca en julio del 2011 y seguía tratamiento habitual con Luminal 0.1, Enalapril 5 mg, Furosemida 40 mg, Omeprazol 20 mg y Tranxilum 5 mg, Galdar 2,5.
En julio de 2013 es remitida a la consulta externa de Hematología por sospecha de síndrome linfoproliferativo al presentar una linfocitosis absoluta de 14 x 10 9 con hemoglobina y plaquetas normales; tras el estudio de extensión, se diagnostica de Leucemia Linfática Crónica B estadio I de Rai/B de Binet con del (11q-).
El 19 y 20 de mayo de 2014, inició tratamiento quimioterápico por progresión con ciclos de quimioterapia con Rituximab 375 mg/m² día 1 del ciclo y Bendamustina 90 mg/m² días 1 y 2 cada 28 días. Se asoció a dicho tratamiento Ondansetron 8 mg, como profilaxis emetógena, Trimetropima-Sulfametoxazol 160/800 mg cada 12 horas los sábados y domingos, Ácido fólico 5 mg, un comprimido al día los sábados y domingos, como profilaxis infecciosa y Alopurinol 300 mg un comprimido diario 7 días desde el inicio del tratamiento, como profilaxis de la hiperuricemia.
Recibe el segundo ciclo a las mismas dosis y con la misma medicación concomitante los días 16 y 17 de junio. El segundo día de tratamiento, transcurridas aproximadamente 8 horas de la administración de Bendamustina, la paciente acudió al Servicio de Urgencias por presentar sensación distérmica, fiebre de hasta 40°C sin focalidad, desorientación, debilidad, erupción maculopapular eritematosa no pruriginosa en mitad inferior de abdomen y espalda. No refería odinofagia, tos, diarrea ni disuria.
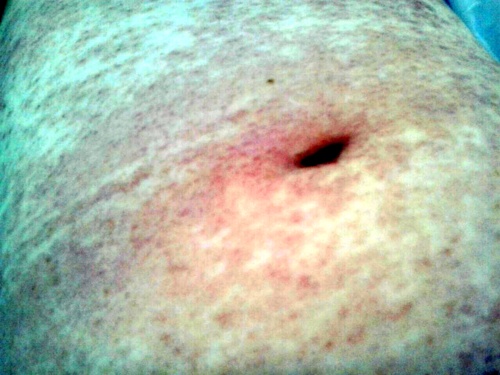
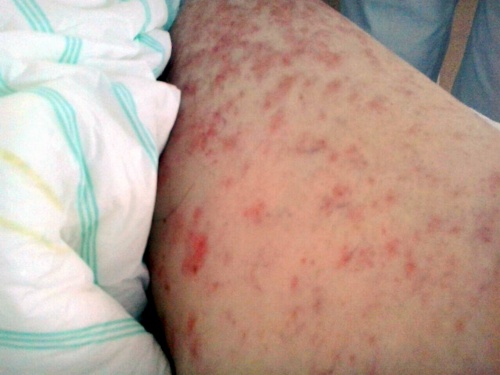
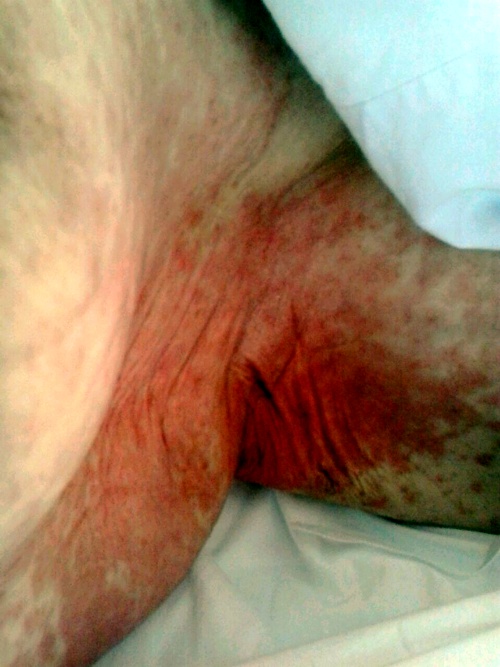
En la exploración física se objetivaron lesiones máculo-papulares eritematosas, infiltradas y no pruriginosas, en abdomen, espalda, huecos axilares y raíz de muslos; siendo la auscultación cardíaca y pulmonar normal. (Figuras 1, 2 y 3)
Las exploraciones complementarias solicitadas mostraron un hemograma con los siguientes valores: hemoglobina 12.1 gr/dl, V.C.M. 98.1 fl, leucocitos 9.2 x 109 con neutrófilos 8.8 x 109, linfocitos 0.1 x 109 y plaquetas 116 x 109. El estudio de coagulación reveló un tiempo de protrombina del 49% con INR 1.6 y tiempo de tromboplastina parcial activado normal. En la bioquímica destacaban los siguientes valores, urea 75, creatinina 1.93, GPT 53, amilasa 282, sodio 137; la PCR fue de 180 y la procalcitonina de 28.1, con un ácido láctico de 2,5. En el sistemático de orina los nitritos fueron negativos y en el sedimento se apreciaba abundante flora bacteriana, sin embargo el urocultivo efectuado fue negativo así como el hemocultivo y la antigenemia de citomegalovirus.
En la radiografía de tórax no se apreciaban condensaciones y en la ecografía abdominal se observaban numerosas adenopatías en el hilio hepático, retropancreáticas, en la cadena ilíaca derecha y en ambas regiones inguinales.
Con el diagnóstico de Sepsis de probable origen Urinario se pautó tratamiento antibiótico de amplio espectro con Piperacilina- Tazobactam y Amikacina y vitamina K para corregir el alargamiento del Tiempo de Protrombina. A las 24 horas del ingreso persistía fiebre elevada por lo que se amplió el tratamiento antibiótico con Teicoplanina, y Caspofungina, cambiando Piperacilina- Tazobactam a Meropenem. En este momento comenzó la mejoría clínica y analítica con normalización de la función renal y de la cifra de amilasa.
A los 5 días del ingreso se apreció aumento del exantema eritematoso por lo que se consultó con el Servicio de Alergología que consideró las lesiones secundarias a Bendamustina y Alopurinol; inició tratamiento corticoideo con Metilprednisolona a la dosis 40 mg/12 h; a los 6 días de este tratamiento, el cuadro había mejorado sensiblemente, quedando sólo lesiones residuales por lo que se pasó a tratamiento corticoideo oral con reducción progresiva de la dosis hasta la suspensión.
A los 20 días del ingreso el exantema había desaparecido. La paciente continuó tratamiento quimioterápico con ciclos de Rituximab y Clorambucilo.
DISCUSIÓN
Dentro de las reacciones adversas medicamentosas las reacciones adversas cutáneas o toxicodermias son las más frecuentes. La incidencia de reacciones cutáneas adversas a medicamentos puede superar el 10%, y oscilan desde una lesión leve a cuadros graves que comprometen la vida. En los pacientes hospitalizados, la incidencia de reacciones medicamentosas cutáneas varía entre el 1 y 3%4.
La Leucemia Linfática Crónica (LLC) es la leucemia más frecuente en países de Europa y en Estados Unidos, con una incidencia de 2 a 6 casos por 100.000 habitantes/año5; afecta principalmente a personas de edad avanzada siendo la edad media al diagnóstico de unos 70 años y con un ligero predominio en varones.
Un régimen alternativo en el tratamiento de la LLC es la combinación de Bendamustina y Rituximab6. Tanto en los pacientes anteriormente tratados como en los que no han sido tratados, la Bendamustina y el Rituximab han mostrado una tasa de respuesta del 70 al 90%7-8.
Las reacciones a la perfusión de Bendamustina han sido frecuentes en los ensayos clínicos e incluyen síntomas leves como fiebre, escalofríos, prurito y erupciones cutáneas. En casos excepcionales se han producido reacciones anafilácticas y anafilactoides graves3.
Se han notificado erupciones cutáneas en el 9-16% de los pacientes con LLC y LNH tratados con Bendamustina en fase de ensayos clínicos y en la experiencia post-comercialización; se han descrito casos de necrólisis epidérmica tóxica y síndrome de Stevens-Johnson, aunque la relación con el fármaco no estaba clara debido al uso concomitante de Alopurinol o Rituximab, agentes implicados previamente con esas reacciones idiosincrásicas2,9-10.
Bassel y col. han publicado la aparición de "dermatitis flagelada" inducida por Bendamustina en un paciente con LLC siendo ésta una dermatitis solo descrita con la administración de Bleomicina11. Y Alamdari y col. presentaron el caso de un paciente con LNH que desarrolló una erupción cutánea grave con un patrón histológico de "dermatitis de interfase" asociado a bendamustina12.
En otro caso, una paciente con Leucemia-B prolinfocítica tratada con bendamustina desarrolló tras la primera dosis del tratamiento una erupción maculopapular generalizada severa, que posteriormente progresó a una púrpura palpable con placas hemorrágicas sospechosas de vasculitis leucocitoclástica13.
Hay que destacar que en el tratamiento con Bendamustina, las reacciones de hipersensibilidad dificultan la administración óptima del mismo, siendo la suspensión de la Bendamustina y el cambio de tratamiento, la actitud terapéutica usual; no obstante, se han elaborado protocolos de desensibilización a Bendamustina, que han permitido pautar el citostático sin complicaciones graves14.
En nuestro caso, el tratamiento con corticoides permitió la resolución del cuadro y como tratamiento posterior para la LLC se optó por un cambio de tratamiento, eliminando el alopurinol en los ciclos subsiguientes.
REFERENCIAS
-
1.- Leoni LM, Bailey B, Reifert J, et al.: Bendamustine (Treanda) displays a distinct pattern of cytotoxicity and unique mechanistic features compared with other alkylating agents. Clin Cancer Res. 2008; 14 (1): 309-317.
2.- Treanda [package insert]. Frazer, PA: Cephalon, Inc.; 2008.
3.- Ficha técnica de Levact®. Laboratorio Astellas Pharma GMBH, 2010.
4.- Svensson CK, Cowen EW, Gaspari AA. Cutaneous drug reactions. Pharmacol Rev. 2001; 53: 357-379.
5.- Swerdlow SH, Campo E, Harris NL, Jaffe ES, Pileri SA, Stein H, Thiele J, Vardiman JW. WHO Classification of Tumours of Hematopoietic and Lymphoid Tissues. 2008. 4a Ed. Lyon.
6.- Maurer C, Hallek M. Chronic lymphocytic leukemia. Dtsch Med Wochenschr 2013; 138: 2153-2166.
7.- Fischer K, Cramer P, Busch R, et al.: Bendamustine combined with rituximab in patients with relapsed and/or refractory chronic lymphocytic leukemia: a multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol 2012; 30: 3209-3216.
8.- Iannitto E, Morabito F, Mancuso S, et al.: Bendamustine with or without rituximab in the treatment of relapsed chronic lymphocytic leukaemia: an Italian retrospective study. Br J Haematol 2011;153: 351-357.
9.- Fallon MJ, Heck JN. Fatal Stevens-Johnson syndrome/toxic epidermal necrolysis induced by allopurinol-rituximab-bendamustine therapy. J Oncol Pharm Pract. 2014 Jul 7. 1078155214533368. [Epub ahead of print]
10.- Malipatil B, Ganesan P, Sundersingh S, Sagar TG. Preliminary experience with the use of bendamustine: a peculiar skin rash as the commonest side effect. Hematol Oncol Stem Cell Ther. 2011; 4: 157-160.
11.- Mahmoud BH, Eide MJ. Bendamustine-Induced "Flagellate Dermatitis" Dermatology Online Journal 2012; 18:12.
12.- Alamdari HS, Pinter-Brown L, Cassarino DS, Chiu MV. Severe cutaneous interface drug eruption associated with bendamustine. Dermatology Online Journal 2010; 16: 1.
13.- Gavini A, Telang GH, Olszewski AJ. Generalized purpuric drug exanthem with hemorrhagic plaques following bendamustine chemotherapy in a patient with B-prolymphocytic leukemia. Int J Hematol. 2012; 95: 311-314.
14.- Sangrador C, Luis MM, Martínez-Garcia M, Pérez-Serrano L, Soler E. Toxicodermia by bendamustine: development of a desensization protocol. Farm Hosp 2013; 37: 4213.
CORRESPONDENCIA:
Dra. Beatriz Cuevas Ruiz
Servicio de Hematología-Hemoterapia
Hospital Universitario de Burgos.
Avda. de las Islas Baleares 3
09006 Burgos. España
bcuevas @ hubu.es
Recibido, 1 de abril de 2014.
Publicado, 30 de junio de 2014