Indice del volumen Volume index
Comité Editorial Editorial Board
Comité Científico Scientific Committee
TUMOR PARDO EN PALADAR DURO COMO PRIMERA MANIFESTACIÓN DE HIPERPARATIROIDISMO SECUNDARIO
1Gustavo Aroca-Martínez MD. PhD., 2Diego Serna-Otero, MD , 2Amilkar Almanza-Hurtado, MD, 3Rodrigo Molina MD, 1Raul E. Garcia-Toloza MD, 4Carlos G. Musso MD. PhD.
1Universidad Simón Bolívar, Clínica de la Costa, Barranquilla;
2Universidad del Sinú seccional, Cartagena;
3Universidad Libre, Barranquilla. Colombia.
4Unidad de Biología del Envejecimiento, Hospital Italiano de Buenos Aires. Argentina.
Email: garoca1 @ unisimonbolivar.edu.co
Rev Electron Biomed / Electron J Biomed 2018;2:29-38.
RESUMEN
El tumor pardo es una forma localizada de osteítis fibrosis quística, una rara expresión no neoplásica del hiperparatiroidismo (HPT) ya sea primario, secundario o terciario.
En el presente reporte se presenta el caso de una mujer de 22 años con enfermedad renal crónica desde los 9 años de edad secundaria a nefritis lúpica, en hemodiálisis quien consultó por masa expansiva de crecimiento rápido en región maxilar superior que resulto ser una forma rara de tumor pardo y que fue tratada con tratamiento médico y quirúrgico.
Conclusión: El tumor pardo de paladar duro como primera manifestación de hiperparatiroidismo secundario es infrecuente y su tratamiento suele depender de una estrategia combinada.
PALABRAS CLAVE: Tumor pardo. Hiperparatiroidismo. Nefropatía
ABSTRACT: BROWN TUMOR IN HARD PALATE AS THE FIRST MANIFESTATION OF SECONDARY HYPERPARATHYROIDISM
The brown tumor is a localized form of osteitis cystic fibrosis, a rare non-neoplastic expression of hyperparathyroidism, either primary, secondary or tertiary.
In the present report we present the case of a 22-year-old woman with chronic kidney disease from 9 years of age secondary to lupus nephritis, on hemodialysis who consulted for an expansive mass of rapid growth in maxillary region which resulted a rare form of brown tumor and that was treated with medical and surgical treatment.
Conclusion: The brown hard palate tumor as the first manifestation of secondary hyperparathyroidism is infrequent and its treatment usually depends on a combined strategy.
KEY WORDS: Brown tumor, Hyperparathyroidism, Nephropathy
INTRODUCCIÓN
El tumor pardo es una forma localizada de osteítis fibrosis quística (OFQ), una rara expresión no neoplásica del hiperparatiroidismo (HPT) ya sea primario, secundario o terciario. Se caracteriza por presentar lesiones quísticas expansivas en el hueso, a menudo mal diagnosticadas como lesiones neoplásicas, granulomatosas o abscesos en hueso.
A nivel radiológico puede detectarse afección de huesos largos, clavículas y pelvis, de crecimiento lento y que pueden llegar a ser localmente destructivas. La incidencia de aparición de la lesión en los huesos maxilares es del 4.5%, siendo su ubicación más frecuente en la mandíbula que en el maxilar superior1-7.
Sin embargo, en la actualidad se considera anecdótico encontrar tumor pardo como manifestación de HPT secundario, ya que con los tratamientos médicos se intentan corregir las alteraciones fosfo-cálcicas en etapas tempranas. En la literatura se reportan cambios esqueléticos como desmineralización generalizada, resorción subperióstica, quistes óseos y fracturas patológicas 3.
El tumor pardo ha sido descrito como manifestación ósea del hiperparatiroidismo primario en relación con adenoma o neoplasia de paratiroides, por el contrario, es una expresión rara en el hiperparatiroidismo secundario en pacientes con enfermedad renal crónica de larga evolución en respuesta al desequilibrio cálcico por hiperplasia del tejido paratiroideo y aumento de la producción de la hormona paratiroidea 4-5.
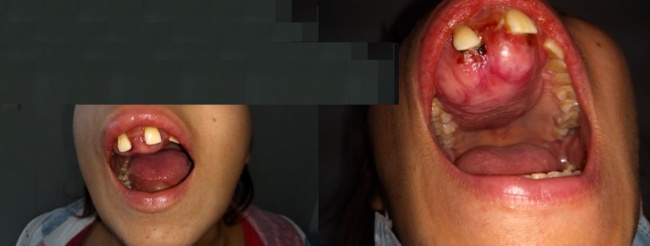
En el presente reporte presentamos el caso de una mujer de 22 años con enfermedad renal crónica desde los 9 años de edad secundaria a nefritis lúpica, en terapia dialítica 3 veces por semanas, quien consultó por masa dolorosa, expansiva, de crecimiento rápido en región maxilar derecha de 5 meses de evolución (Figuras 1-4).
CASO CLÍNICO:
Mujer de 22 años, con antecedente de lupus eritematoso sistémico (LES) desde 2007, portadora de enfermedad renal crónica (ERC) estadio 5 en terapia dialítica desde 2009 secundaria a nefritis lúpica (NL), en manejo con prednisolona 5 mg día, acido fólico 1 mg dia, sulfato ferroso 300 mg dia, eritropoyetina 2000 UI 3 veces por semana, y que además recibió manejo preventivo para osteodistrofía renal con suplementos de calcio y calcitriol desde el año 2009 hasta el 2016. Fue remitida al servicio de cirugía de cabeza y cuello de esta Institución por masa de 5 meses de evolución, dolorosa, expansiva en maxilar superior derecho, de crecimiento acelerado con sangrado intermitente que deformaba hemicara derecha con compromiso de la arcada dental superior.
Al examen físico presentaba: tensión arterial: 110/60 mmHg, frecuencia cardíaca: 82 latidos por minuto, frecuencia respiratoria: 18 respiraciones por minuto, con presencia de masa dura deformante, localizada en lado derecho del paladar duro de 7 cms x 4.5 cms, la cual comprometía la tabla ósea vestibular y las piezas dentarias anteriores.
Examen cardio-pulmonar sin alteraciones, abdomen sin alteraciones, extremidades: sin sinovitis, sin ulceras digitales, sin fenómeno de Raynaud, sin edemas periféricos. Laboratorios séricos: Creatinina: 5,02 mg/dl (0,9-1,3 mg/dl), BUN: 28 mg/dl (8-26 mg/dl), urea: 53 mg/dl (15-38 mg/dl), albumina: 3,3 g/dl (3,2-5 g/dl), acido úrico: 5,1 mg/dl (2,5-7,5 mg/dl), paratohormona intacta (PTH): 1.650 pg/ml (8,7-77,1 pg/ml), calcio: 9 mg/dl (8,5-10,5 mg/dl), fosforo: 4,5 mg/dl (2,5-4,5 mg/dl), potasio: 3,9 mmol/L (3,5-5,5 mmol/L), leucocitos: 8300/mm3 (neutrófilos: 90%, linfocitos: 5.5%), hemoglobina: 9,3 g/dl, plaquetas: 232.000/mm3, TSH: 2,3 mUI/L, fosfatasa alcalina: 404 UI/L, proteínas totales: 7,1 g/dl, TGO: 30 UI/L, TGP: 12 UI/L, tiempo de tromboplastina (PTT): 29,3 segundos, tiempo de protrombina (PT): 12 segundos, INR 1,1, citomegalovirus IgG e IgM negativo, Elisa VIH negativo, hepatitis B y C negativos, Epstein Barr IgG e IgM negativos.
En cuanto a la tomografía computada de cráneo simple dentro de límites normales, ecocardiograma transtorácico Doppler color Modo M-Bidimensional: normal. Se realizó por parte de cirugía maxilofacial extirpación de la lesión, con posterior inicio de cinacalcet a dosis de 30 mg/dia. Se realizó estudio histo-patológico de la lesión (Figuras 5 a b y c )
Tomografía computada (TAC) de cráneo simple: dentro de límites normales.
Informe de la tomografía computada: Se identifica lesión ocupante de espacio de densidad de partes blandas voluminosa que compromete paladar duro y paladar blando con destrucción ósea de piezas dentarias del maxilar superior con predomino de los incisivos mediales, laterales y molares con destrucción de los alveolos dentarios, se extiende en sentido cefálico y compromete ambos antros maxilares, predominio del antro maxilar izquierdo con erosión ósea de la pared anterior y medial del antro maxilar derecho y pared anterior, medial y lateral del antro maxilar izquierdo, con erosión ósea de celdillas etmoidales izquierdas y del tabique nasal, compromete el piso de la órbita, y ejerce efecto de masa sobre el globo ocular izquierdo que condiciona discreta proptosis.
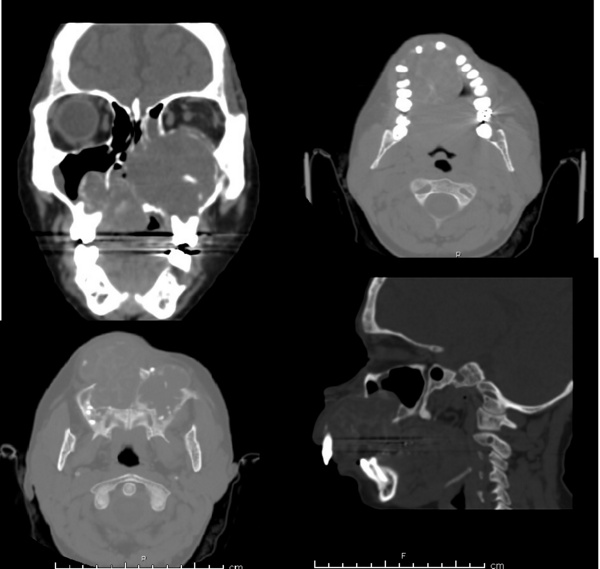
Figura 2. Foto de TAC de cara + 3D.
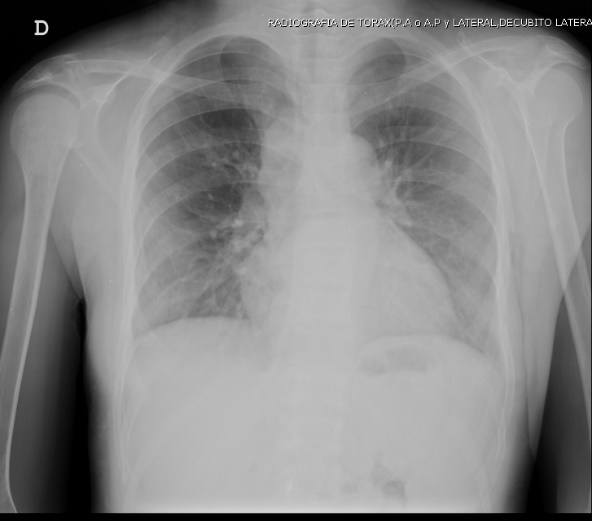
Figura 3. Radiografía de tórax frente dentro de límites normales.
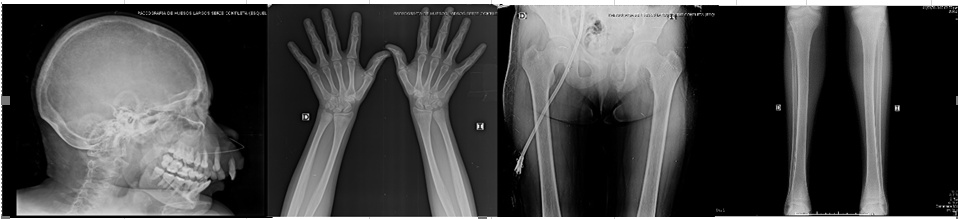
Figura 4. RadiografíaS de huesos largos sin evidencia de lesiones líticas, blásticas ni fracturas.
Se presentó el caso en junta médica y se decidió que ante la ausencia de repuesta al tratamiento médico y el compromiso severo, se decidió su evaluación por cirugía maxilofacial quien realizó resección parcial de la masa en paladar duro y reconstrucción quirúrgica del paladar (Figura 5).
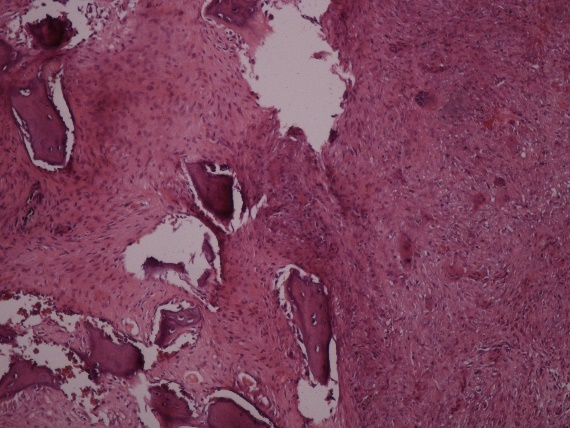
Figura 5a.Estudio anatomopatologico (Visión panorámica con objetivo 4x): Se observa espículas de hueso con
componente fibroso en el fondo, presencia de células grandes multinucleadas.
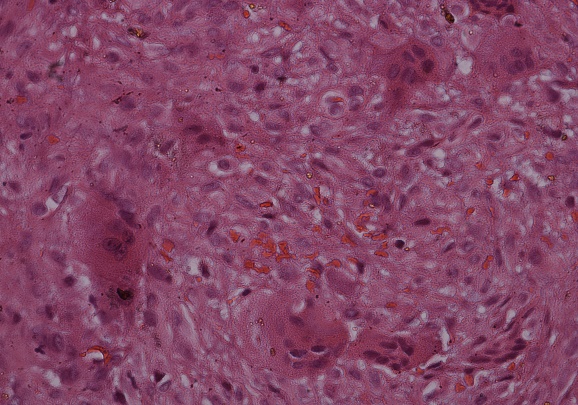
Figura 5b. (Objetivo 10x): Se observa tejido fibroso,
células gigantes multinucleadas en un fondo con abundante extravasación de hematíes.
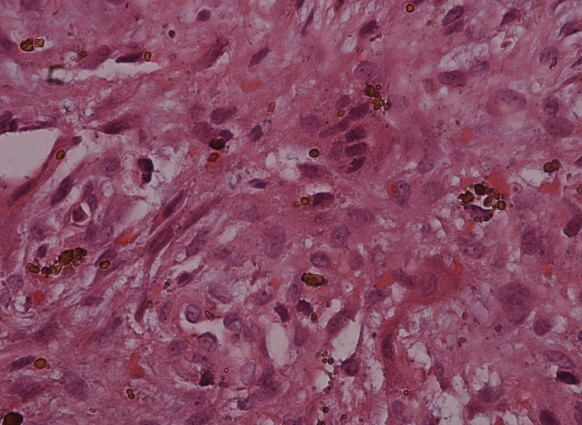
Figura 5c. (Objetivo 40x). Pigmento de hemosiderina fagocitado por algunas de las células gigantes multinucleadas,
característica que le confiere el nombre de color pardo al tumor.
DISCUSIÓN:
El tumor pardo es una forma localizada de osteítis fibrosa quística, como manifestación rara de HPT secundario en el contexto de una osteodistrofía renal, y que posee una prevalencia de 1,5 a 1,7%. Esta caracterizado por ser una masa benigna, de crecimiento lento, no neoplásica, cuyo origen se debe a los niveles elevados de PTH, que estimula la conversión de osteoblastos a osteoclastos en el hueso, generando una mayor resorción ósea, localmente destructivo, y llevando a lesiones líticas en estudios radiológicos e incluso fracturas patológicas. La PTH moviliza el calcio óseo, lo cual inicialmente se manifiesta como osteopenia difusa y finalmente induce una osteítis fibrosa quística2,6. El nombre tumor "pardo" se debe a la coloración que le confieren las áreas de hemorragia y depósitos de hemosiderina que aparecen en su interior, las cuales poseen además trabéculas óseas irregulares dispersas y cantidades variables de células gigantes multinucleadas en un estroma altamente celular y vascular con depósitos de hemosiderina variables y extravasación de eritrocitos4,7,8. Todos los hallazgos anteriormente descritos se encontraron en el caso clínico aquí reportado, tanto a nivel radiológico como anatomo-patológico.
El HPT es una entidad clínica caracterizada por alteraciones en los niveles de calcio, fosforo, niveles de vitamina D y PTH. Es causado por la secreción aumentada de PTH que puede ser de origen primario, cuya causa es el adenoma paratiroideo (90%), hiperplasia paratiroidea (9%) y el carcinoma de paratiroides (1%).
El HPT secundario se produce en el contexto de una insuficiencia renal crónica y HPT terciario se desarrolla cuando el estímulo prolongado provocado por el HPT secundario sobre la glándula paratiroidea provoca un funcionamiento autónomo de la misma. En nuestro caso clínico encontramos niveles elevados de PTH con niveles de calcio con tendencia a la hipocalcemia y niveles de fosforo en rango de normalidad en relación con HPT secundario. La gammagrafía de glándula paratiroides descartó adenoma y otras anormalidades.
Por las características histológicas se debe hacer el diagnóstico diferencial con el tumor de células gigantes, granuloma central de células gigantes, granuloma periférico de células gigantes, quiste aneurismático y el querubismo; de los anteriores el más frecuente es el tumor de células gigantes (TCG) dada su similitud clínica, radiológica e histopatológica y en estos casos se debe realizar un diagnóstico rápido dada la agresividad del TCG por su potencial metastásico a pulmones. En nuestro caso clínico se descartó esta patología por la presencia de niveles elevados de PTH y radiografía de tórax normal8,9.
De acuerdo con las guías KDIGO el HPT secundario se maneja con calcimiméticos, calcitriol o análogos sintéticos de la vitamina D, solo o en combinación, para su uso se debe tener niveles séricos de fosfato < 5.5 mg/dl y calcio < 9.5 mg/dl. El calcitriol y los análogos sintéticos de la vitamina D aumentan el calcio y fosforo séricos, pueden causar calcificación metastásica y vascular en pacientes con hiperfosfatemia antes de iniciar el tratamiento. A los pacientes con niveles de PTH >800 pg/ml se les recomienda ser tratados con terapia combinada10,11.
Al revisar la literatura no se encontró un consenso para el manejo de tumor pardo por HPT secundario. Se propone en este caso un manejo conservador, controlando los niveles de PTH con análogos de vitamina D, calcimiméticos por 3 a 6 meses de acuerdo con las recomendaciones de las guías KDIGO 2017 y resección parcial del tumor en la zona del paladar duro. En caso de no obtener los resultados esperados a nivel clínico (disminución del tamaño del tumor) y paraclínicos (disminución de los niveles de PTH) se procederá a realizar paratiroidectomía total con posterior reconstrucción de las lesiones causadas por el tumor.
CONCLUSIÓN:
El tumor pardo de paladar duro como primera manifestación de hiperparatiroidismo secundario es infrecuente y su tratamiento suele depender de una estrategia combinada.
APROBACIÓN ETICA: Este artículo no contiene ningún estudio con humanos participantes o con animales por parte de los autores.
DECLARACIÓN DE CONSENTIMIENTO DEL PACIENTE: Los autores certifican que han obtenido todos los formularios de consentimiento del paciente. En la forma en que la paciente ha otorgado su consentimiento para que sus imágenes y demás información clínica sean reportadas en la revista. La paciente entiende que sus nombres e iniciales no serán publicados y se harán los esfuerzos necesarios para ocultar su identidad, pero no se puede garantizar el anonimato.
APOYO FINANCIERO Y PATROCINIO: Ninguno.
CONFLICTO DE INTERESES: No hay conflicto de intereses.
REFERENCIAS
-
1. Yadav V, Loomba A, Autar R. Original Article A comparative evaluation of dental calcification stages and skeletal maturity indicators in North ? Indian children. Natl J Maxillofac Surg. 2017;8:26-33.
2. Chavin HC, Pisarevsky ANAA, Chavin C, Cátedra VI, Interna DM, Clínicas H De, et al. Caso clínico. 2008;219-221.
3. Chang JI, Som PM, Lawson W. Unique imaging findings in the facial bones of renal osteodystrophy. Am J Neuroradiol. 2007;28:608-609.
4. Sirotheau Corrêa Pontes F, Ajudarte Lopes M, Lacerda de Souza L, dos Santos da Mata Rezende D, Roger Santos-Silva A, Jorge J, et al. Oral and maxillofacial manifestations of chronic kidney disease-mineral and bone disorder: a multicenter retrospective study. 2018]; Available from: https://www-clinicalkey-es.consultaremota.upb.edu.co/service/content/pdf/watermarked/1-s2.0-S2212440317310672.pdf?locale=es_ES
5. Otero JM, Miranda SC, Grandal MF. Tumores pardos en paciente con hiperparatiroidismo secundario en hemodiálisis . Presentación de caso Brown tumours in a hemodialysis patientwith secondary. 2015;14:118-126.
6. Encinas A, González A, Nú B, Fernández E, Millón A, Calatayud J. Cirugía Oral y Maxilofacial Tumor pardo de localización mandibular como primera manifestación clínica del hiperparatiroidismo Brown tumor of the mandible as first presentation of hyperparathyroidism. 2012;5:189-191.
7. Ramos B, Piñero A, Illana J, Palazón T, Méndez S, Parrilla Paricio P. Tumor pardo maxilar como primera manifestación del hiperparatiroidismo primario. Cir Esp. 2001;69:498-500.
8. Suarez-Cunqueiro MM, Schoen R, Kersten A, Klisch J, Schmelzeisen R. Brown tumor of the mandible as first manifestation of atypical parathyroid adenoma. J Oral Maxillofac Surg [Internet]. 2004;62:1024-1028. Available from: http://www.ncbi.nlm.nih.gov/pubmed/15278870
9. Sanromán JF, María I, López AC. Tumor pardo en la sínfisis mandibular como primera manifestación clínica de hiper- paratiroidismo?: diagnóstico y tratamiento Brown tumor of the mandible as fi rst manifestation of primary hyperparathyroidism?: diagnosis and treatment. Oral Cir Bucal. 2005;10:169-172.
10. Ketteler M, Block GA, Evenepoel P, et al. Executive summary of the 2017 KDIGO Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD) Guideline Update: what's changed and why it matters. Kidney Int. 2017;92:26-36. Kidney Int [Internet]. 2017;92:1558. Available from: http://linkinghub.elsevier.com/retrieve/pii/S0085253817307238
11. National Kidney Foundation. K/DOQI clinical practice guidelines for bone metabolism and disease in chronic kidney disease. Am J Kidney Dis. 2003;42(4 Suppl 3:S1-201. Available from: http://www.ncbi.nlm.nih.gov/pubmed/14520607
CORRESPONDENCIA:
GUSTAVO AROCA-MARTINEZ MD. PhD.
Universidad Simón Bolívar
Clínica de la Costa.
Barranquilla, Colombia
Email: garoca1 @ unisimonbolivar.edu.co
